嵌合抗原受体T(CAR-T)细胞治疗是一种有潜力的过继细胞治疗策略的个体化癌症免疫治疗领域。
CAR-T细胞治疗在B细胞恶性血液病的治疗中引发了一场革命,并在其他难治性恶性血液病患者中产生了显著的临床疗效。目前,已经有五种FDA批准的靶向CD19或BCMA分子的CAR-T细胞疗法,用于治疗复发的难治性B细胞急性淋巴细胞白血病、大B细胞非霍奇金淋巴瘤、复发的难治性套细胞淋巴瘤和复发的难治性多发性骨髓瘤。
然而,由于肿瘤的异质性和肿瘤微环境(tumor microenvironment, TME)的复杂性,其治疗实体瘤的疗效尚未得到证实。TME通常含有许多免疫抑制细胞,如调节性T细胞(Treg)、髓系干细胞(MDSC)、肿瘤相关巨噬细胞(TAMs),以及肿瘤组织中的免疫抑制分子,缺乏抗肿瘤免疫细胞的浸润。所有这些都明显削弱了CAR-T细胞治疗实体肿瘤的抗肿瘤作用。而近年来研究者发现了肿瘤细胞免疫逃逸机制中的关键蛋白—CD47的高表达能够抑制巨噬细胞和树突状细胞对肿瘤细胞的识别和吞噬作用。二者联系在一起,中山大学医学院黄朝峰博士及其团队在今年2月以“Delivery of CD47 blocker SIRPα-Fc by CAR-T cells enhances antitumor efficacy”为题发表于“ImmunoTherapy of Cancer”杂志中。

该团队开发了分泌CD47阻滞剂Sirf CAR-T细胞,SIRPα-Fc蛋白,以研究其是否能增强巨噬细胞的吞噬能力和CAR-T细胞在实体肿瘤中的治疗效果。这项研究揭示了SIRPα-Fc蛋白与CAR-T细胞联合用于实体肿瘤治疗的潜力。
首先,由于Trop2可以作为CAR-T细胞的靶点,在研究团队之前的文章(“CD27 enhances the killing effect of CAR T cells targeting trophoblast cell surface antigen 2 in the treatment of solid tumors”)中证明过小鼠T2-CAR-T细胞的抗肿瘤作用。因此这里选用小鼠T细胞转导来表达传统的抗Trop2 CAR和Sirf CAR(即T2-m28z与Sirf如图A),以及选用未转导的T细胞来作为阴性对照。
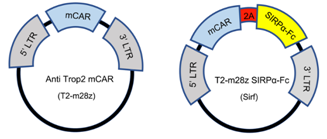
通过对CAR-T细胞培养上清进行anti-His免疫印迹,进一步证实了CAR-T细胞分泌SIRPα-Fc,目的蛋白存在于Sirf CAR-T细胞上清中,而T2-m28z中不存在(图B)。

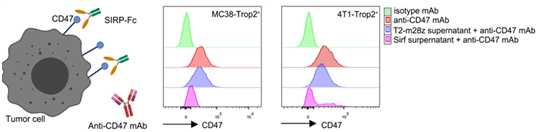
研究团队使用了基于流式细胞术的抗体竞争实验。在MC38-Trop2和4T1-Trop2肿瘤细胞上发现CD47在基线水平高表达。而与Sirf CAR-T细胞上清共孵育后,CD47染色的荧光强度显著降低,但与T2-m28z CAR-T细胞共孵育后没有下降(图C)。结果表明Sirf CAR-T细胞分泌的SIRPα-Fc蛋白可以与肿瘤细胞上的CD47分子结合。
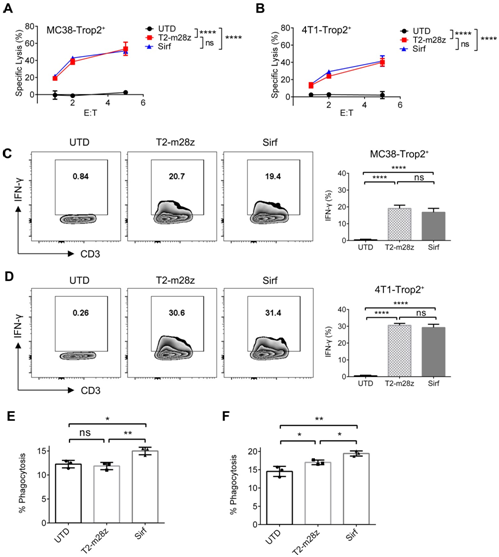
接下来,为了确定SIRPα-Fc是否影响CAR- T细胞的杀伤能力,研究团队执行LDH释放试验,结果表明Sirf和T2-m28z CAR-T细胞都对MC38-Trop2+细胞和4T1-Trop2+细胞表现出相似的肿瘤溶解能力(图1A,B)以及IFN-γ的表达(图1C,D)。这说明分泌SIRP α-Fc对体外CAR-T细胞的抗肿瘤作用没有不利影响。随后,团队测试了加入不同CAR-T细胞培养上清后对肿瘤细胞的吞噬能力。结果显示,Sirf CAR-T细胞上清与传统CAR-T细胞相比可以增强吞噬作用(图1E)。此外,CAR-T细胞经肿瘤抗原刺激后可诱导IFN-γ表达。研究团队分析了不同CAR-T细胞与MC38-Trop2+细胞共培养后的上清对巨噬细胞的吞噬作用。发现Sirf CAR-T细胞上清液比未转导的T细胞或传统CAR-T细胞上清液有明显的促进吞噬作用(图1F)。
总之,这些体外数据表明分泌的SIRPα-Fc蛋白增强巨噬细胞的吞噬能力,但不损害CAR-T细胞的活性。
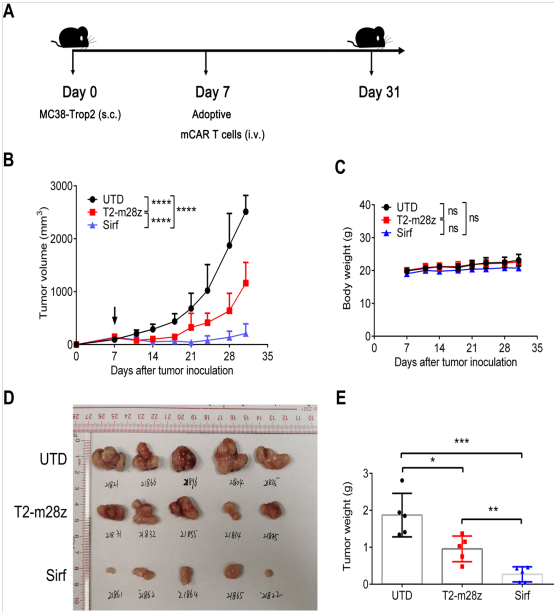
下一步是探究Sirf CAR-T细胞在免疫小鼠模型中的抗肿瘤活性。团队用C57BL/6小鼠接种MC38-Trop2+ (s.c.),然后用Sirf CAR-T细胞、T2-m28z CAR-T细胞与未转染基因的活化T细胞处理(图2A)。与对照组相比,T2-m28z CAR-T和Sirf CAR-T细胞对肿瘤生长都有中度的抑制作用(图2B)。Sirf CAR-T细胞治疗的小鼠与T2-m28z CAR-T细胞治疗的小鼠相比,可以观察到对肿瘤生长的附加控制。从体重变化可以看出,治疗与潜在毒性无关(图2C)。在第31天切除肿瘤(图2D) 进一步检验CAR-T细胞的抗肿瘤疗效,Sirf CAR-T细胞治疗组的肿瘤体积显著减少(图2E)。
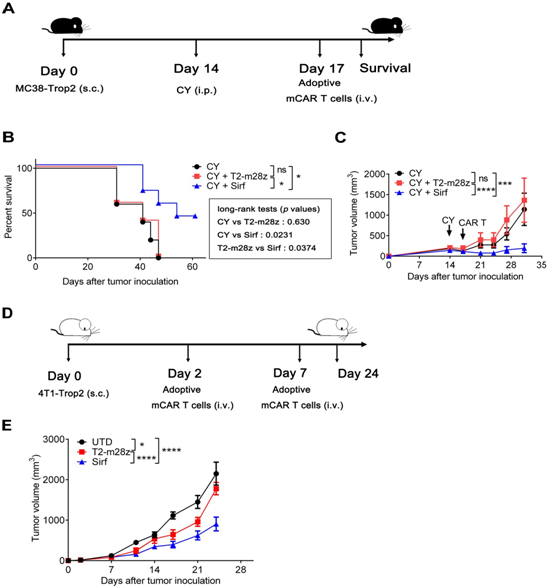
在许多临床实践中,CAR-T细胞治疗通常需要低剂量的氟达拉滨或CY预处理。为了确定联合治疗效果,小鼠接种MC38-Trop2+ (s.c.),使用CY (i.p.)预处理,然后静脉注射CAR-T细胞(图3A)。在这个治疗过程中,Sirf CAR-T细胞的使用显著延长了小鼠的生存时间(图3B)和减少了肿瘤负担(图3C)。此外,Sirf CAR-T细胞的强抗肿瘤治疗效果在4T1-Trop2+模型中也得到了进一步的证实(图3D)。Sirf CAR-T细胞治疗能显著减少肿瘤体积,而T2-m28z CAR-T细胞治疗效果有限(图3E)。
这些结果表明Sirf CAR-T细胞可以提高对实体肿瘤的治疗效果。
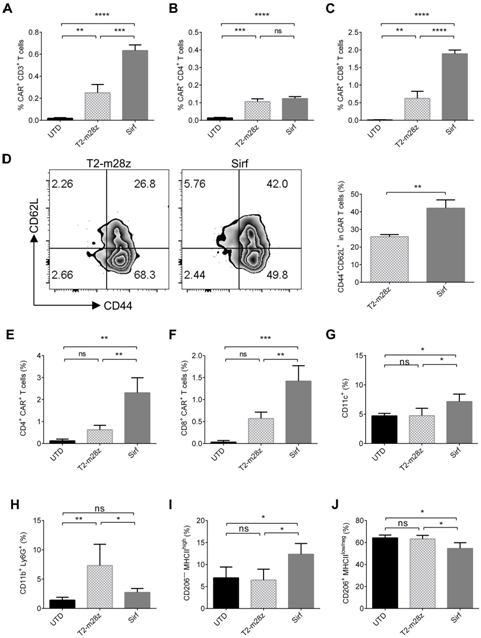
然后,研究团队用流式细胞术分析了分泌的SIRPα-Fc是如何调节荷瘤小鼠体内免疫细胞的,SirfCAR-T细胞处理的小鼠脾脏CD3+T细胞中CAR-T细胞的比例高于T2-m28z组,而在CD8+CAR-T细胞中则更为显著(图4A-C)。此外,Sirf CAR-T细胞提高了小鼠脾细胞中CD44+CD62L+中央记忆T细胞(TCM)的比例(图4D)。果然,在Sirf CAR-T细胞治疗的肿瘤组织中CAR-T细胞的比例显著高于对照组(图4E,F)。此外,在Sirf CAR-T细胞治疗的肿瘤组织中,CD11c+DC的比例增加(图4G),而髓系源性抑制细胞(MDSC)的比例下降(图4H)。Sirf CAR-T细胞处理后,M1型巨噬细胞比例增加(图4I),M2型巨噬细胞比例减少(图5J),表明Sirf CAR-T细胞的治疗可以增强巨噬细胞的抗肿瘤功能。即Sirf CAR-T细胞产生的SIRPα-Fc不仅可以增强CAR-T细胞的持久性,而且可以影响TME。
最后,团队分析了不同CAR-T细胞在MC38-Trop2+肿瘤细胞抗原刺激后表面标记物的变化。与体内研究结果一致,观察到TCM在Sirf CAR-T细胞中的比例明显高于T2-m28z CAR-T细胞(图5A)。随后,检测了CAR+T细胞与肿瘤细胞共培养后的凋亡。在肿瘤抗原刺激后,Sirf CAR-T细胞中凋亡细胞比T2-m28z CAR-T细胞中凋亡细胞少(图5B),但不能被肿瘤抗原刺激的非CAR-T细胞中凋亡细胞没有差异(图5C)。此外,还发现程序性细胞死亡1 (PD-1)在Sirf CAR-T细胞上的表达低于T2-m28z CAR-T细胞(图5D)。表明PD-1通路参与调控Sirf CAR-T细胞的抗肿瘤作用。

在这项研究中,该团队开发了Sirf CAR-T细胞,可以产生CD47阻断剂,SIRPα-Fc融合蛋白。从实验结果来看Sirf CAR-T细胞在体内显示了强大的抗肿瘤活性和提高了对实体肿瘤的治疗效果。结果显示,CAR-T细胞分泌的SIRPα-Fc增强了巨噬细胞的吞噬能力,改进了CAR-T细胞的持续凋亡,并减少了肿瘤组织中的免疫抑制。这些体现Sirf CAR-T细胞在实体肿瘤治疗中的潜力。
文章来源: https://pubmed.ncbi.nlm.nih.gov/35110357/
