“去年8月,芬兰赫尔辛基大学药学院的研究人员开发了一种溶瘤腺病毒Ad-Cab(腺病毒嵌合抗体),其表达了一种嵌合IgG-IgA (IgGA) Fc抗PD-L1的Fc融合肽,称为IgGA。该融合肽由一个包含IgG1和IgA1恒定区的交叉杂交Fc区组成,并通过GGGS与PD-1胞外域连接。结果表明该融合肽不仅能够激发IgG1的效应机制,也能激发IgA1的效应机制,从而激活被IgG1忽视的中性粒细胞,将多种免疫效应机制结合起来,激活多种免疫成分,增强对不同癌细胞系、患者来源的肾癌细胞的肿瘤细胞毒作用。相关研究结果以‘Novel oncolytic adenovirus expressing enhanced cross-hybrid IgGA Fc PD-L1 inhibitor activates multiple immune effector populations leading to enhanced tumor killing in vitro, in vivo and with patient-derived tumor organoids’为题发表在免疫疗法的癌症杂志(JITC)上。”。

免疫检查点抑制剂(ICI)疗法已被确立为治疗许多肿瘤类型的有效选择,并极大地扩大了肿瘤的治疗范围。然而,越来越多的证据表明,检查点抑制剂只能使一小部分患者受益。在许多治疗中ICI疗法要么是有限的,要么完全不能诱导与抗体相关的关键的抗体依赖性效应机制,如补体依赖性细胞毒性(CDC)或抗体依赖性细胞毒性/吞噬作用(ADCC/ADCP)。基于临床数据,激活效应器机制是治疗性抗体达到肿瘤清除的必要条件。此外,ADCC和CDC等效应器机制已被认为是某些靶向CTLA48或PD-L1的改良ICIS增强抗肿瘤应答所必须的。
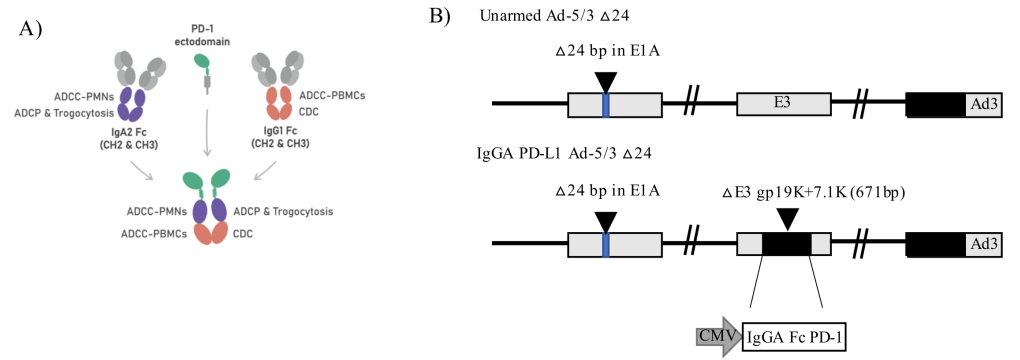
因此,研究人员开发了一种针对PD-L1的Fc融合肽,它由一个包含IgG1恒定区和IgA1恒定区的杂交Fc区组成,称为IgGA,与PD-1胞外区相连,通过甘氨酸连接子增加其与PD-L1的亲和力。然而,携带有免疫能力的Fc区可能是一把双刃剑,因为免疫检查点无处不在地表达,而且这种抗体是系统给药的,经常导致irAE(免疫相关不良反应)。为了绕过这一障碍,研究人员通过将Fc融合肽克隆到溶瘤腺病毒中,限制了Fc融合肽只能直接在肿瘤微环境中表达。本文中研究人员开发了一种溶瘤腺病毒Ad-Cab(腺病毒嵌合抗体),表达了一种嵌合IgG-IgA (IgGA) Fc,并将其克隆到E3A基因的gp19K+7.1K区域。

研究人员首先用Ad-Cab或未改造的溶瘤腺病毒(Ad-5/3MDA-24)以两种不同的感染复数(MOI,10和100)感染肿瘤细胞2天,以限制人细胞系(MDA-MB-436和A549)的溶瘤作用。随后,研究人员在培养液中加入具有补体活性的血清,这时可以观察到 Ad-Cab 在感染肿瘤细胞后,发生了不同程度的细胞裂解,在MOI为10时,细胞开始发生裂解,且随着MOI增加到100,在所有六种细胞系中的细胞裂解进一步增强。
接着,研究人员用两种不同的免疫群体来做ADCC检测:PBMC和PMN,与CDC相比,在MOI为10时,当添加PBMC或PMN时,用Ad-Cab感染的所有细胞系都可以观察到ADCC的最小诱导或没有诱导。最后,研究人员测试Ad-Cab激活巨噬细胞和诱导ADCP的能力,其中引发ADCP的能力用CFSE标记的肿瘤细胞系的巨噬细胞摄取CFSE来确定。在MOI为10 时,在任何条件下均未观察到CFSE摄取,但在MOI增加到100时,且在肿瘤细胞感染Ad-Cab后,在所有细胞系中都可以观察到巨噬细胞对CFSE的摄取量增加。
通过这一系列体外实验,研究者证明了该种杂交Fc区使ICI(免疫检查点抑制剂)能够在各种肿瘤细胞系中引发IgA和IgG介导的多种效应机制,随后多种效应机制的激活进一步增强了肿瘤杀伤,并被证明优于PD-L1 IgG1抗体或Atezolizumab(目前已被FDA批准的ICI)。
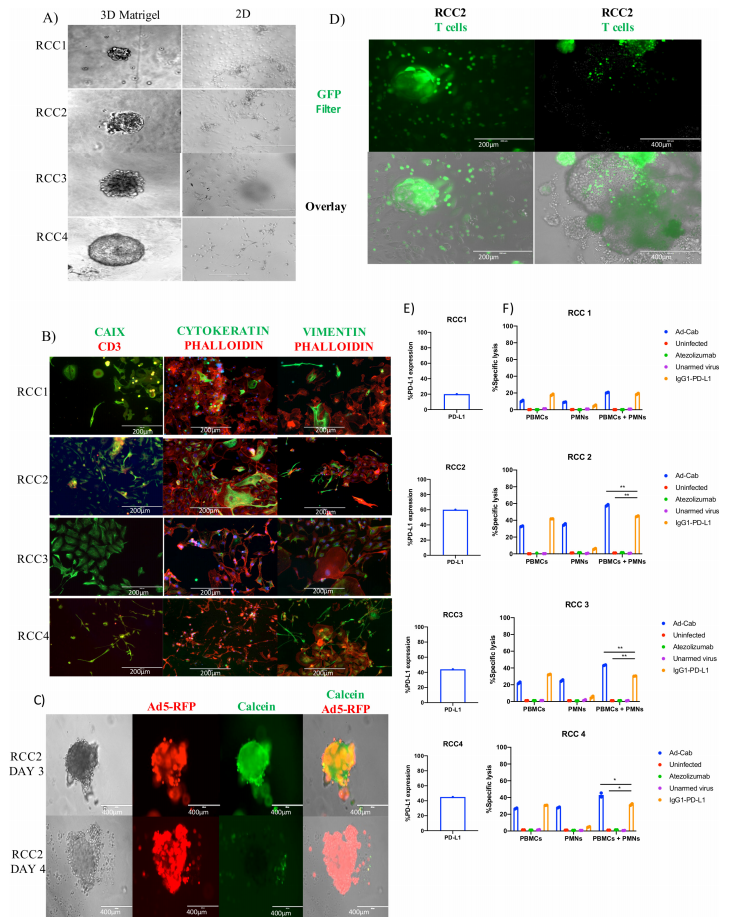
为了进一步研究Ad-Cab中IgA介导肿瘤杀伤的效果,研究者开发了一个使用肾癌患者来源的类器官,即一个直接从患者肿瘤组织开发来的(RCC PDO)新型测试平台。在将RCC类器官做为Ad Cab的功能测试平台后,研究者使用它们来测试PBMC和PMN的ADCC效果,RCC类器官首先被病毒感染或用抗体处理并孵育3天,从ADCC结果可以明显看出,当将PBMC添加到RCC时,在加Ad-Cab和IgG1+PD-L1抗体的这两组中观察到相似水平的细胞毒性。
与体外数据一致,但当添加PMN作为效应细胞时,只能用Ad-Cab观察到细胞毒性,而不能用IgG1+PD-L1抗体观察到细胞毒性,且当同时添加两个效应细胞群时,与单独添加每个群时相比,明显观察到Ad-Cab增强了对细胞的杀伤。因此,PDO进一步加强了Ad-Cab的疗效和免疫系统协同清除肿瘤的能力。
研究结果表明,这种新型溶瘤腺病毒表达的Fc融合肽能够活化通常由IgG1抗体激活的PBMC,并能激活一个经常被忽视但重要的群体PMN(中性粒细胞)。且这两种群体的共同参与被证明具有协同作用,并在各种PD-L1表达的细胞系和RCC PDO中增强了溶瘤腺病毒对肿瘤的杀伤,这样的临床前结果将促进研究人员对Ad-Cab的进一步研究。
文章来源:http://dx.doi.org/10.1136/jitc-2021-003000
