靶向程序性细胞死亡-1(PD-1)/程序性细胞死亡配体-1(PD-L1)或细胞毒性T淋巴细胞相关抗原-4(CTLA-4)的免疫检查点抑制剂(ICIs)因其强大而持久的治疗功效已成为最令人印象深刻的免疫疗法之一。然而,它们的临床疗效因杀伤性T细胞的消耗和肿瘤微环境(TME)中免疫抑制性T细胞的募集而受到极大阻碍。
由于缺乏T细胞募集的肿瘤浸润淋巴细胞和趋化因子,ICI的抗肿瘤作用显著降低,尤其是在免疫原性较差的肿瘤中,例如肾癌、TNBC、宫颈癌和神经胶质瘤。前期临床研究显示,对三阴性乳腺癌(TNBC)患者的治疗中,ICI单药使用效果不佳,因此亟需一些能够增强ICI敏感性的药物联用解决这个问题。
溶瘤病毒的出现,打破了肿瘤微环境,能够将“冷”肿瘤转变为“热”肿瘤。本项研究中,作者在免疫健全BALB/c小鼠中建立了TNBC原位模型,通过溶瘤病毒rAd.GM(携带GM-CSF基因的溶瘤腺病毒)与ICI的联合治疗,发现溶瘤病毒通过调节TME溶瘤病毒可显著增强抗PD-L1和抗CTLA-4(aPC)的抗肿瘤作用。此外,aPC也阻碍了溶瘤病毒治疗后的免疫逃逸,因此,作者提供了治疗TNBC的有效联合策略。
联合治疗可有效抑制免疫活性4T1原位模型的肿瘤生长和延长生存期
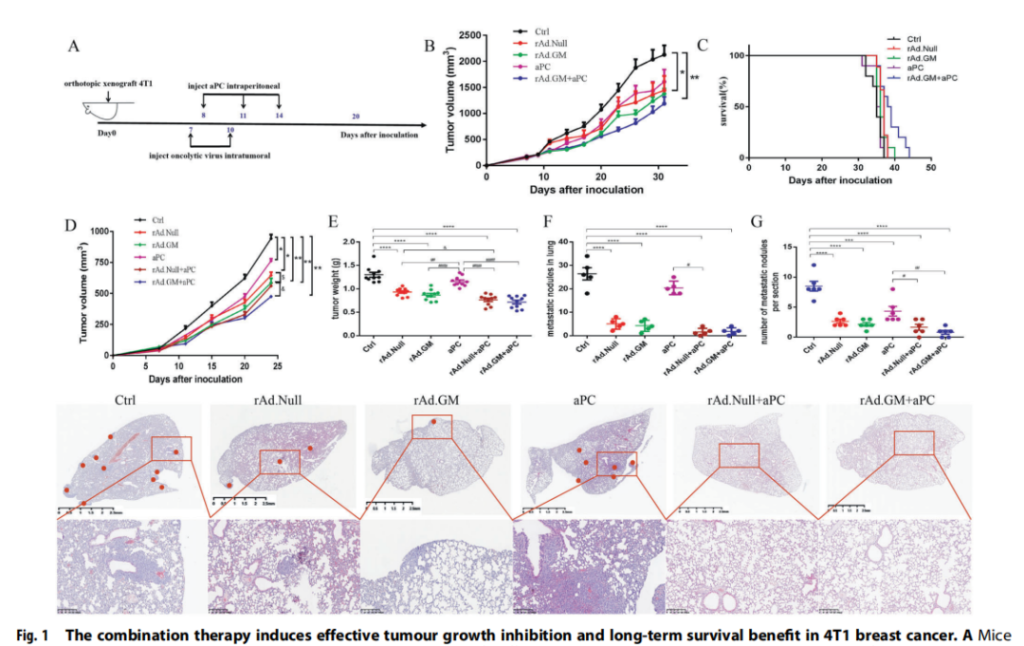
结果表明,与对照相比,aPC治疗抑制了肿瘤生长并略微延长了生存期,而溶瘤病毒单用效果一般。aPC和rAd.GM的联合疗法比其他疗法效果更显著。与对照组相比,联合治疗组的小鼠肿瘤体积减少了约50%,存活时间延长了1周。不仅如此,联合治疗还能够有效抑制肿瘤转移,大约20%小鼠肺部未发现任何转移灶。
联合治疗促进肿瘤细胞凋亡和坏死
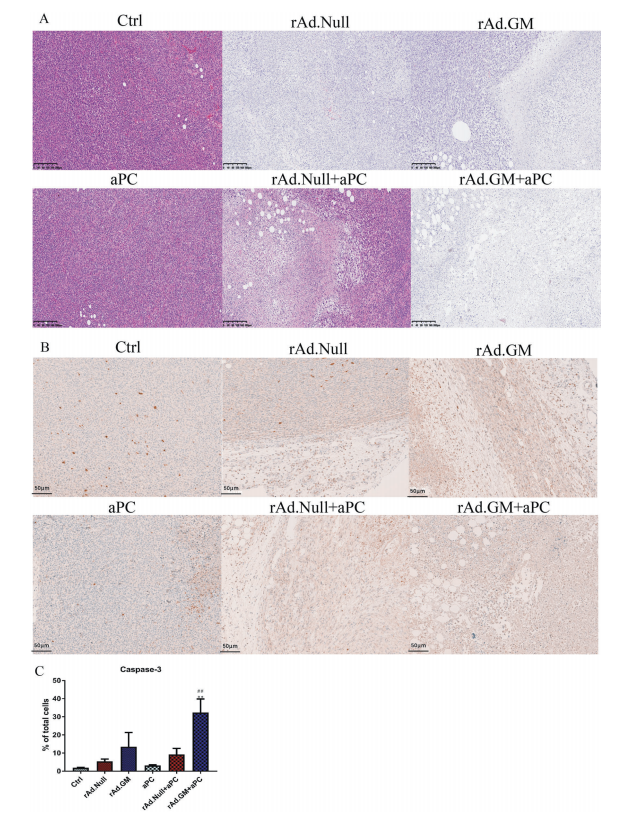
组织病理学分析和IHC结果表明,5种治疗组均促进肿瘤细胞凋亡和坏死。溶瘤病毒尤其是rAd.GM的作用优于APC(图1、2A、B)。此外,联合治疗组caspase-3的表达明显高于相应的溶瘤病毒组,说明其明显诱导的细胞凋亡。重要的是,rAd.GM联合治疗组的凋亡率高于rAd.Null联合治疗组(图1、2C)。
联合疗法通过调节淋巴细胞浸润和巨噬细胞极化来重组TME
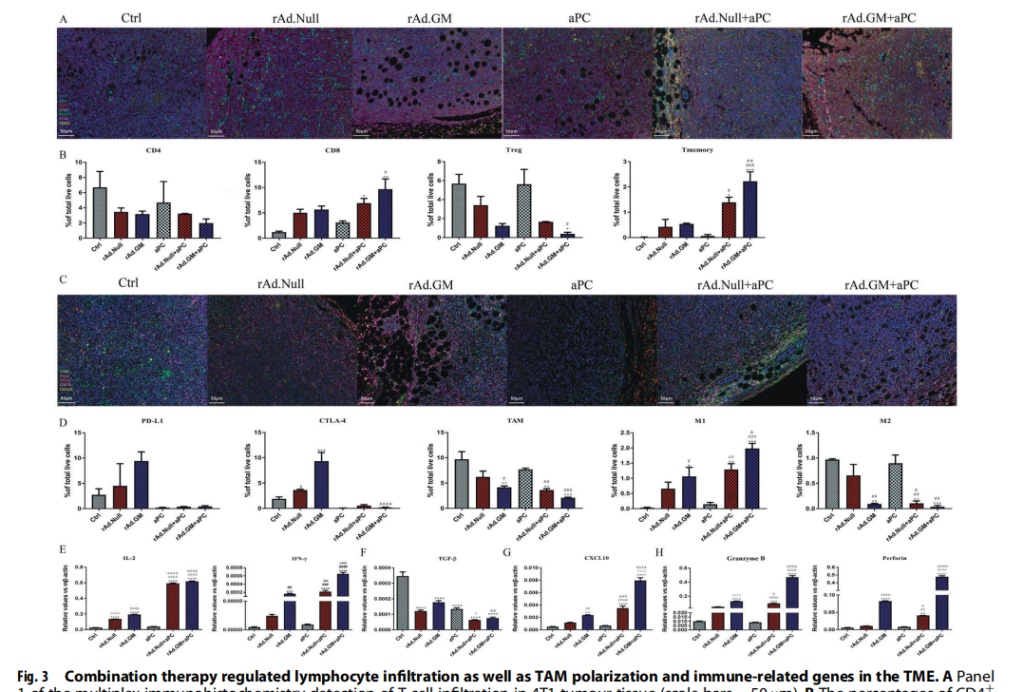
联合治疗可显著提高CD8+的表达和减少CD4+T细胞,增加记忆T细胞的比例,抑制Tregs的浸润。联合治疗可减少TME中TAMs的数量,并使巨噬细胞从M2向M1表型分化。rAd.GM和APC的联合应用不仅抑制了巨噬细胞的募集,还促进了巨噬细胞从M2向M1表型的极化。此外,CTLA-4和Pd-L1在溶瘤溶瘤病毒治疗组中表达上调,但与APC联合使用后表达降低。
溶瘤病毒通过增加CD8+T细胞和记忆T细胞以及下调外周血中的Treg细胞来增强aPC的抗肿瘤免疫反应
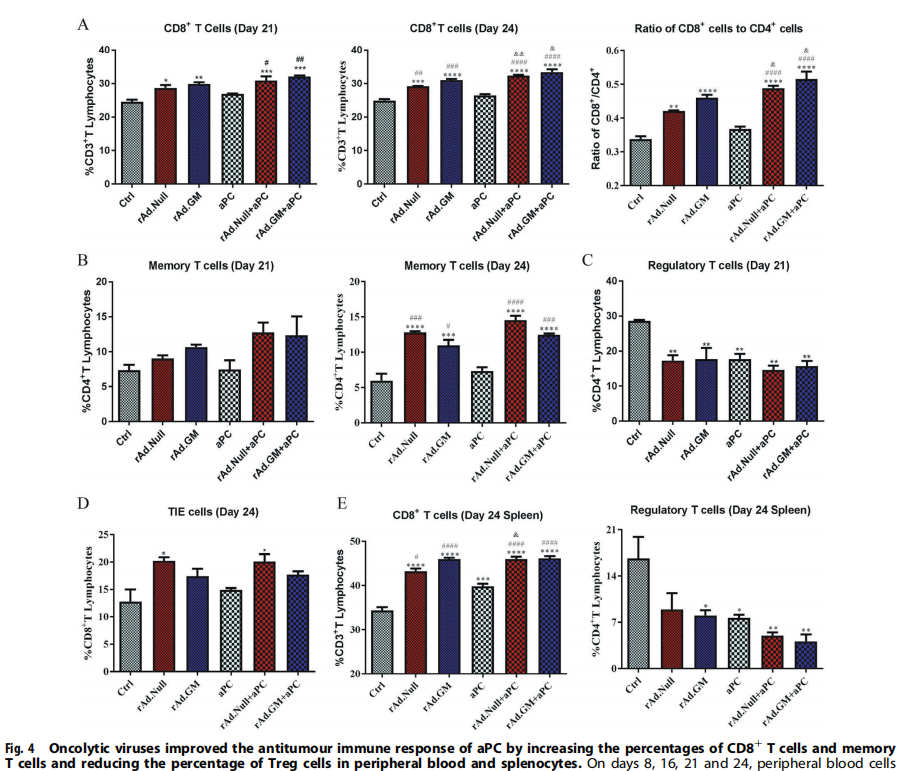
溶瘤病毒组和联合治疗组显示出CD8+T细胞百分比增加溶瘤病毒组和联合治疗组CD4+CD44+CD62L高T记忆细胞百分比在第21天和24天上调,联合治疗组CD4+T记忆细胞百分比高于相应的溶瘤病毒组和aPC组(图4B)。与溶瘤病毒组和aPC组相比,联合治疗还下调了CD4+T淋巴细胞中CD25+FoxP3+Treg的百分比(图4C)。与对照组和aPC组相比,溶瘤病毒组和联合治疗组显示出外周血中TIE细胞的百分比增加。
溶瘤病毒治疗体外免疫激活效应的研究
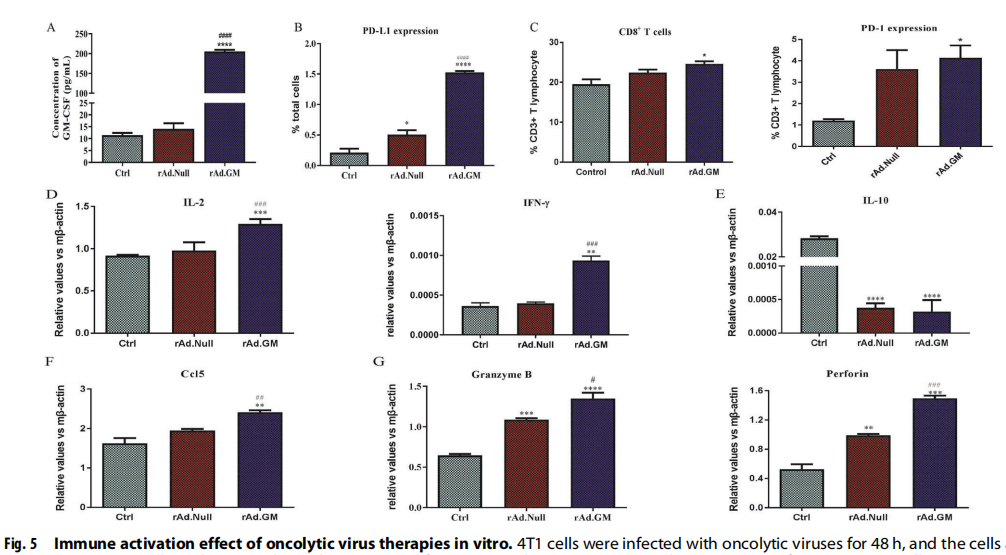
用rAd.GM和rAd.Null感染4T1细胞。结果表明,感染rAd.GM的4T1细胞产生较高水平的GM-CSF蛋白,并分泌到细胞外培养基中(见图)。5A)。rAd.GM增加了pd-L1在4T1细胞中的表达。5B)。为观察腺病毒的免疫激活作用,作者制备了腺病毒感染的4T1细胞裂解上清液,并与小鼠脾细胞共培养3d。
作者发现裂解上清液中pd-1+和CD8+的比例增加了。脾细胞和rAd.GM转导细胞中的T淋巴细胞表现优于rAd.Null转导细胞(见图)。5C)。此外,与对照组相比,溶瘤病毒治疗组,特别是rAd.GM治疗组的脾细胞,中,显著增加了Th1细胞因子5D)和细胞毒性相关基因的表达5G),降低了Th2细胞因子的表达。5E)。此外,rAd.GM还上调了可以招募更多的T细胞的趋化因子的表达。5F)。
结果与讨论
联合治疗组的疗效是本研究中最有意义的,其抑瘤效果和提高生存率均优于其他单药组。联合治疗组的T细胞活性明显高于单用溶瘤病毒治疗组,改变了CD8+与CD4+T细胞的比例。联合治疗能有效降低巨噬细胞比例,使巨噬细胞从M2向M1表型极化,从而调节TME。联合治疗可上调细胞毒性相关基因的表达,调节Th1/Th2平衡,增加趋化因子的表达,增加肿瘤T细胞浸润的密度。溶瘤病毒与APC联合治疗,特别是rAd.GM和APC联合治疗,可以多种方式逆转TNBC的肿瘤免疫抑制微环境,具有协同抗肿瘤作用。
参考文献:Zhang, H., Xie, W., Zhang, Y. et al. Oncolytic adenoviruses synergistically enhance anti-PD-L1 and anti-CTLA-4 immunotherapy by modulating the tumour microenvironment in a 4T1 orthotopic mouse model. Cancer Gene Ther (2021). https://doi.org/10.1038/s41417-021-00389-3
