肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs)是免疫抑制性肿瘤细胞微环境(Immunosuppressive tumor microenvironment,TME)中主要的成分,包括两大类的巨噬细胞,M1和M2型巨噬细胞。其中M2型占大多数,这些巨噬细胞通过分泌生长因子、基质降解酶和促血管生成因子等多种机制支持肿瘤生长。此外,还通过产生一系列抗炎细胞因子(如IL-10)和消耗T细胞功能所必需氨基酸的酶(如Arginase 1)抑制免疫细胞,或通过表达抑制性免疫检查点配体(如PDL1)等多种方式促进肿瘤的生长。而M1型巨噬细胞的功能与M2型相反,它可以抑制肿瘤的生长,协同其他免疫细胞发挥抗肿瘤的免疫功能。基于此,在TME中对TAMs重编程,是一种有效抗肿瘤策略。
目前包括CAR-T在内的新一代治疗策略可对TME进行重新编程。相较于常规性的直接靶向肿瘤细胞的CAR-T疗法,新一代CAR-T则是靶向TME中的非肿瘤成分,间接地限制了肿瘤的发生发展。
今年Daniel J. Powell Jr团队在Nature Communications上发表了一篇题为“CAR-T cell-mediated depletion of immunosuppressive tumor-associated macrophages promotes endogenous antitumor immunity and augments adoptive immunotherapy”的文章。该研究团队主要利用CAR-T耗尽FRβ+TAMs(表达FRβ的TAMs亚群具有M2型巨噬细胞表型和功能),最终导致TME的重编程,促进内源性T细胞介导的抗肿瘤作用。

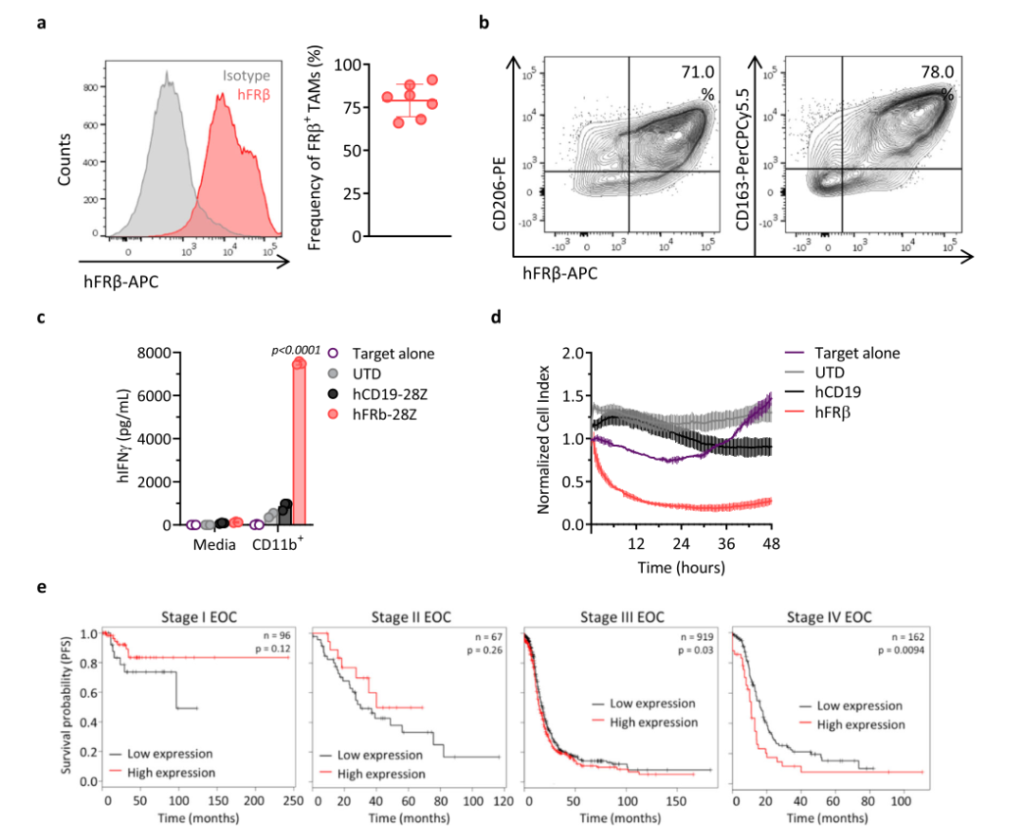
FRβ(叶酸受体β)是一种在急性髓样白血病细胞中表达的糖磷脂酰肌醇锚定的受体,目前已成为CAR-T细胞疗法的肿瘤抗原靶标。该研究团队首先验证了卵巢癌组织中FRβ的表达,发现当肿瘤生长到有腹水形成时,FRβ+TAMs亚群占到了巨噬细胞总数的52.14 ± 11.42%,并且FRβ+TAMs亚群并不是一个静止的状态,而是一个随着肿瘤生长不断增加的亚群;此外,正常小鼠的巨噬细胞在肿瘤细胞培养上清中培养24h,其FRβ的表达也明显增加。
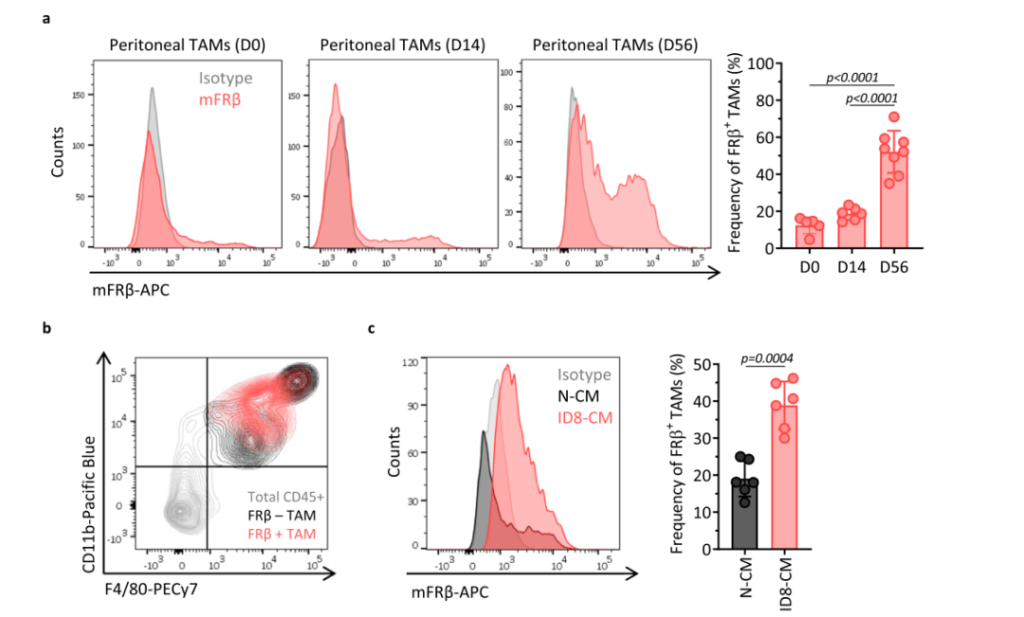
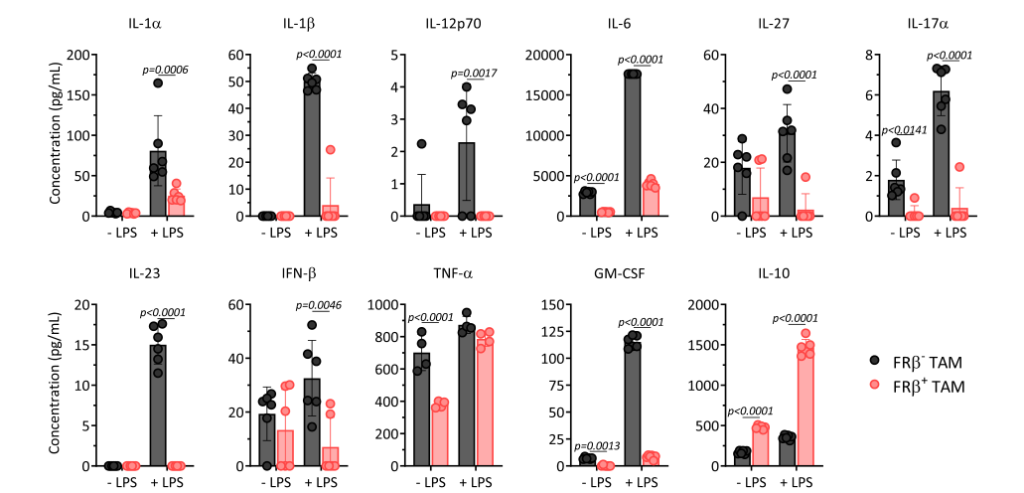
之后,该研究团队利用免疫荧光进一步证实了FRβ+TAMs形态与M2型巨噬细胞一致,FRβ–TAMs形态与M1型巨噬细胞一致。此外,FRβ+TAMs表面高表达CD204,CD206和CD163,与M2表型基本一致。采用多重细胞因子分析法发现FRβ–TAMs分泌IL-6,IL-27,IL-17α,TNF-α,IFN-β和GM-CSF的能力高于FRβ+TAMs;而FRβ+TAMs高分泌IL-10。并且这种能力在LPS的刺激下可进一步增强。
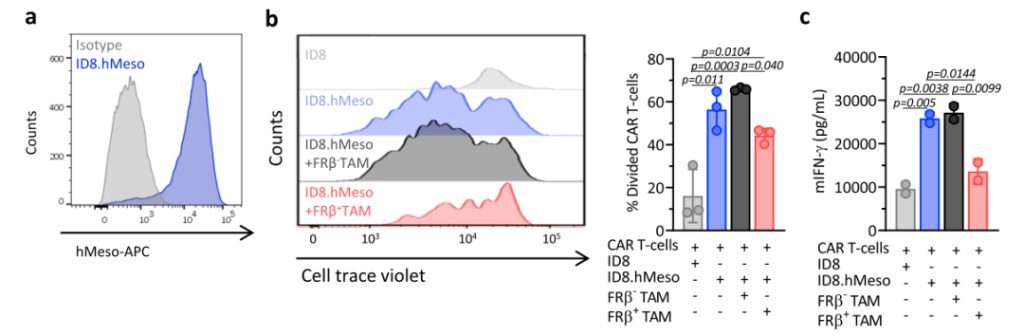
接着,该研究团队验证了具有M2表型的FRβ+TAMs对T细胞的抑制作用。利用小鼠特异性人间皮素(hMeso)的CAR-T 细胞建立了抗原特异性T细胞反应模型。用细胞示踪染料标记hMeso CAR-T细胞,并与工程化的ID8.hMeso细胞共培养,在共培养初期加入分选的 FRβ+或FRβ–TAMs。结果发现,在FRβ+TAMs存在下,hMeso CAR-T的增殖及分泌IFN-γ的能力明显低于加入FRβ–TAMs的情况。
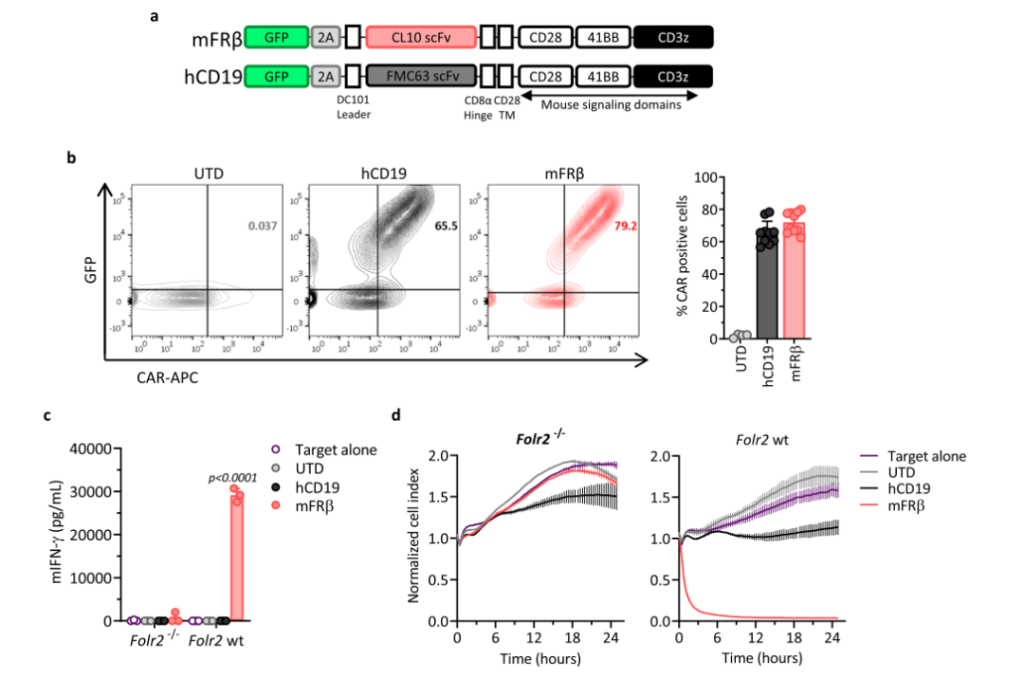
CAR-T细胞疗法已经介导了针对不同抗原的某些类型的癌症的完全缓解。基于此,该研究团队构建了针对FRβ靶点的CAR-T。之后,研究团队从负荷ID8肿瘤的Folr2 wt和Folr2-/-(敲除FRβ基因)小鼠的腹水中分离CD11b+细胞与构建好的CAR-T体外共培养。结果显示,mFRβ CAR-T与Folr2 wt小鼠的TAMs共培养时才能分泌更高水平的IFN-γ和更强的诱导靶细胞裂解的能力。
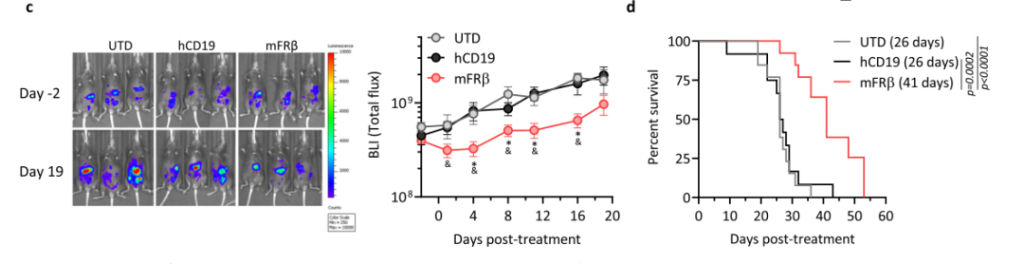
然后,研究团队在ID8小鼠模型中进一步验证了mFRβ CAR-T的作用。发现mFRβ CAR-T细胞导致FRβ+TAMs的耗竭,TME中招募大量的免疫细胞,包括CD11b+细胞和CD8+T细胞。而内源性肿瘤特异性CD8+T细胞的大量涌入,最终抑制了肿瘤的生长并延长了生存时间。
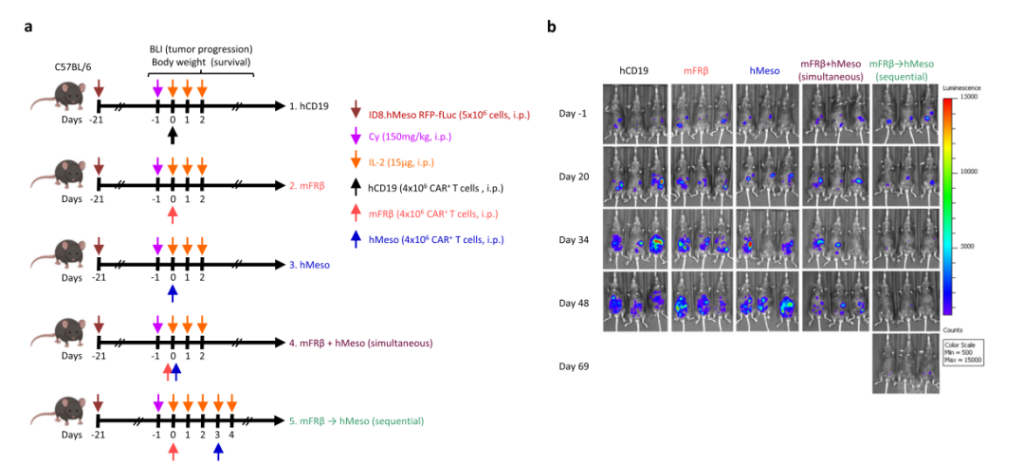
同样的,通过FRβ特异性CAR-T细胞对TME进行预处理也可以提高肿瘤导向性的抗间皮素CAR-T细胞的效果,而同时使用以上两种CAR-T细胞则不能产生相应的效果。接着,研究团队研究了mFRβ CAR-T联合传统靶向肿瘤的CAR-T疗法是否能够增强抗肿瘤效果。为此,在C57BL/6小鼠接种ID8.hMeso肿瘤细胞,21天后,将小鼠随机分成4组(hCD19,mFRβ,hMeso以及mFRβ+hMeso CAR-T)。发现两种CAR-T联合使用并不能提高抗肿瘤效果;而事先通过mFRβ CAR-T细胞对TME进行预处理后,可以提高肿瘤特异性的hMeso CAR-T细胞的效果,延长小鼠的生存期。此外,利用mFRβ CAR-T预处理后,可以增强小鼠血液中hMeso CAR-T的浓度。
之后,该研究团队检测了临床肿瘤样本中FRβ+TAMs,发现几乎所有的肿瘤组织中都存在高比例的FRβ+TAMs,并且FRβ和CD206,CD163共表达,这与在小鼠中发现的类似。此外,采用磁珠法从人腹水中分离 CD11b+细胞,与不同的CAR-T共培养,发现在hFRβ CAR-T 细胞中观察到抗原特异性IFN-γ 的产生和 CD11b+ 细胞(含FRβ+TAMs)的特异性溶解。这为建立CAR-T靶向hFRβ TAMs提供了可行性。最后,为了探讨FRβ 在卵巢癌患者中的临床意义,该研究团队研究了FRβ 基因的表达与无进展生存期(PFS)的相关性。发现,虽然在卵巢癌早期(Ⅰ和Ⅱ期)患者中没有观察到明显的相关性,但是在Ⅲ期和 Ⅳ期表达高 FOLR2的患者与表达低的患者相比,中位生存期明显缩短。并且在其他肿瘤患者中也显示相同的结果。这揭示了重要的预后价值,同时也支持了靶向表达FRβ 免疫抑制性巨噬细胞在癌症患者中的潜在益处。
综上,该研究团队开发了一种针对TAMs的CAR-T,可以将TME重编程为一个促进抗肿瘤免疫反应和限制肿瘤进展的TME,提高其他免疫疗法的疗效,包括CAR-T细胞疗法。以前的研究主要是用单克隆抗体或者小分子药物来靶向TAMs,然而这种策略需要持续给药,以防止巨噬细胞再次的增殖,并且也容易发生全身性细胞毒性;而FRβ CAR-T具有增殖能力,能够在较长时间存在,并且安全性也是比较好的。总之,利用CAR-T靶向免疫抑制性细胞是一种非常有潜力的治疗方法。
