2019年全球淋巴癌发病率调查结果显示,我国淋巴瘤发病率约为6.3/10万人,每年新发病例约为9万人 ,已成为我国男性的第八大高发恶性肿瘤(占比约2.1%)。虽然目前已上市CD19-CAR-T(如Kymriah,yescarta)细胞疗法对B细胞淋巴瘤有较好的疗效,但是需要自体采血,制备周期长、价格昂贵,普通人难以负担;市面上还有CD3/CD19双特异性抗体治疗可供选择,但是其全身性给药易产生细胞因子风暴等严重的毒副作用。因此,迫切地需要新的治疗方法。
溶瘤病毒是一类能够选择性地感染、复制和破坏肿瘤细胞的肿瘤杀伤型病毒,此类产品的生产工艺成熟,可以大批量制备“现货”型治疗药物,大大降低制作的时间和费用成本。2015年,Talimogene laherparepvec(T-VEC)成为首个被FDA批准的溶瘤病毒,用于恶性黑色素瘤的治疗,而后联合PD-1抗体治疗,疗效倍增。这是由于溶瘤病毒可诱导全身性抗肿瘤免疫反应,起到更好的抗肿瘤作用。
近日,荣谷生物研发团队携手浙大二院、浙江省人民医院的专家团队在Nature子刊《Blood Cancer Journal》发表了研究成果“CD19-targeted BiTE expression by anoncolytic vaccinia virus significantly augments therapeutic efficacy againstB-cell lymphoma”。该团队研发了一种能编码 CD19 特异性BiTE的溶瘤痘苗病毒(OVV-CD19BiTE),将免疫治疗和溶瘤病毒治疗整合一体化,并证明其有更高效的抗肿瘤作用。

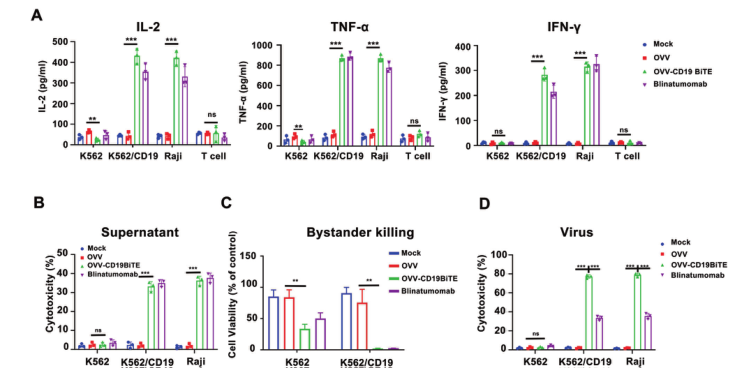
在本研究中,研究团队首先在体外证明了,OVV-CD19BITE能够促进T 细胞的活化和增殖,上调了CD4+和CD8+T细胞上的活化标志物CD25、OX40和4-1BB,显著诱导与T细胞耗竭相关的PD-1表达。此外,OVV-CD19BITE能够诱导T细胞介导的旁观者效应。
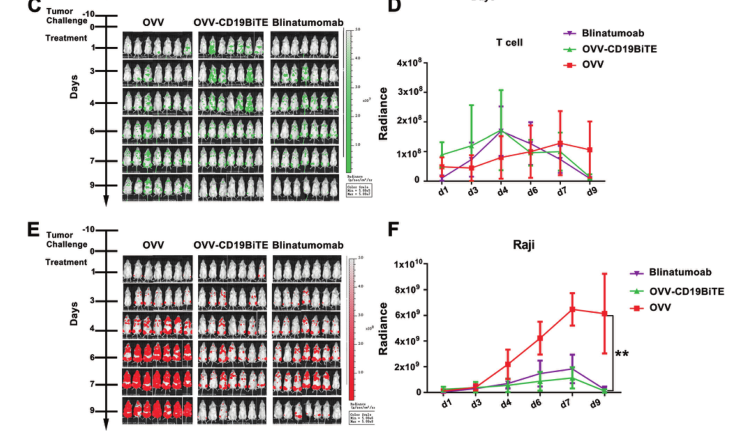
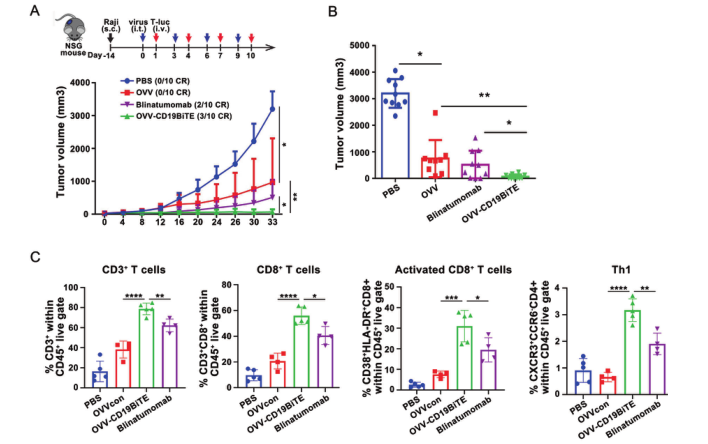
之后,研究团队在体外进一步验证了OVV-CD19BITE的抗肿瘤作用。在NSG小鼠中,通过小动物活体成像体系可以看到,OVV-CD19BITE可以招募更多的T细胞到肿瘤部位,并延长T细胞的生存时间,起到更好的抗肿瘤作用。而通过瘤内治疗OVV-CD19BITE可以抑制肿瘤的生长,延长小鼠的生存期,并且可有效刺激肿瘤微环境内CD3+T细胞、CD8+T细胞、活化CD8+T细胞和Th1细胞的比例,改善了肿瘤微环境,将“冷”肿瘤转变为“热”肿瘤;之后,为了进一步模拟临床上的淋巴瘤,通过NSG小鼠全身成瘤,腹腔治疗的方法,进一步进行验证。结果显示,OVV-CD19BITE可以抑制肿瘤的生长,延长小鼠的生存期。并且,通过小动物活体成像体系可以看到,OVV-CD19BITE组有3只小鼠的肿瘤完全消退,得到了长期的生存。
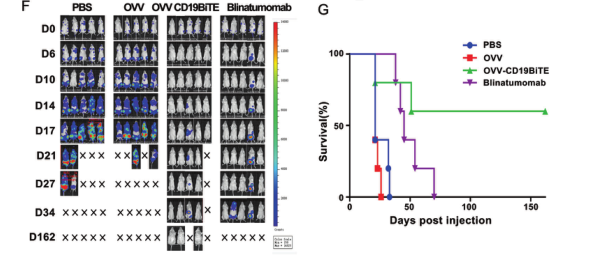
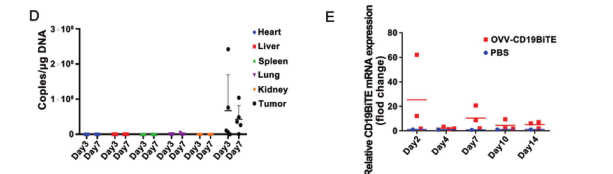
最后,研究团队进一步验证了OVV-CD19BITE的安全性。通过qPCR的方法,只有在肿瘤中可以检测病毒的存在,而在其他组织中没有检测到病毒的残留。说明该重组病毒的安全性是比较好的,为进一步的临床试验做好了准备。