众所周知,晚期胃癌和结直肠癌会引发严重的腹腔积液,并常常导致恶性腹水(MA)的出现。在临床上对于恶性腹水的主要治疗方法是针对恶性肿瘤细胞的治疗,例如化疗和靶向治疗。虽然当前治疗手段在不断的进步,但是仍然存在各种缺点和限制。首先,治疗不能完全停止腹水的产生,因为腹水是由腹膜血管的生成和血管渗透性介导增强产生的,主要是由肿瘤细胞对药物的原发性和继发性抗性引起的。第二,状况不佳的患者,尤其是老年患者,既不适合化疗也不适合手术,而只能接受姑息性容量以减轻压迫症状,包括通过穿刺引流腹水,也就是腹膜分流术。然而这种方法往往会导致蛋白质流失,电解质紊乱,甚至危及生命的感染。
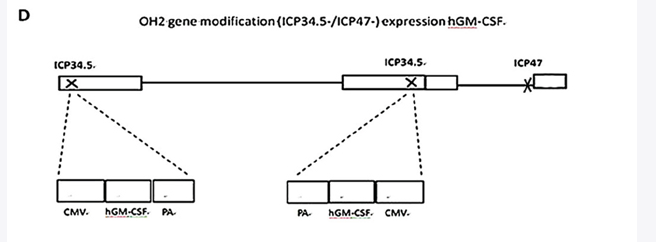
OH2病毒是一种ICP34.5和ICP47基因缺失,并表达人GM-CSF的单纯溶瘤疱疹病毒。ICP47基因的缺失导致US11基因处于ICP47早期启动子的控制之下,而不是处于导致肿瘤选择性复制增强的US11晚期启动子的控制。ICP34.5编码序列替换为由巨噬细胞启动子、编码人类GM-CSF的基因和牛生长激素pA序列组成的序列盒。
1.OH2在体外和体内的溶瘤能力
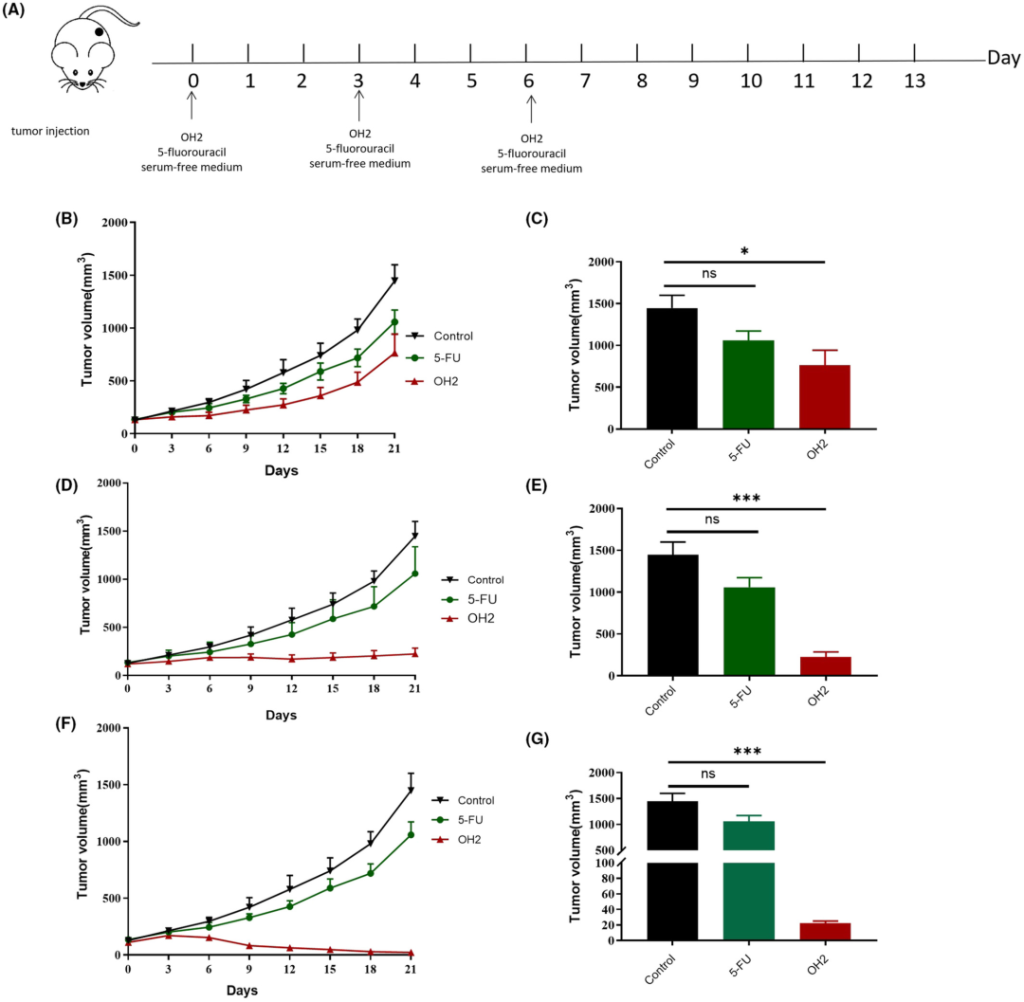
在文中作者构建了CT26小鼠肿瘤模型,分别向肿瘤内注射3种不同剂量的OH2(1E6、1E5、1E4CCID50),观测OH2在体内从第一次给药到第21天后抑制肿瘤生长的情况。(A)治疗方案的模式;(B,C)E4组第21天的肿瘤体积和生长曲线;(D,E)E5组第21天的肿瘤体积和生长曲线;(F,G)E6组第21天的肿瘤体积和生长曲线。以上结果表明OH2能够有效地抑制肿瘤的生长,其中E6和E5可能是腹水研究的合适剂量。
2.OH2抑制小鼠腹水生成
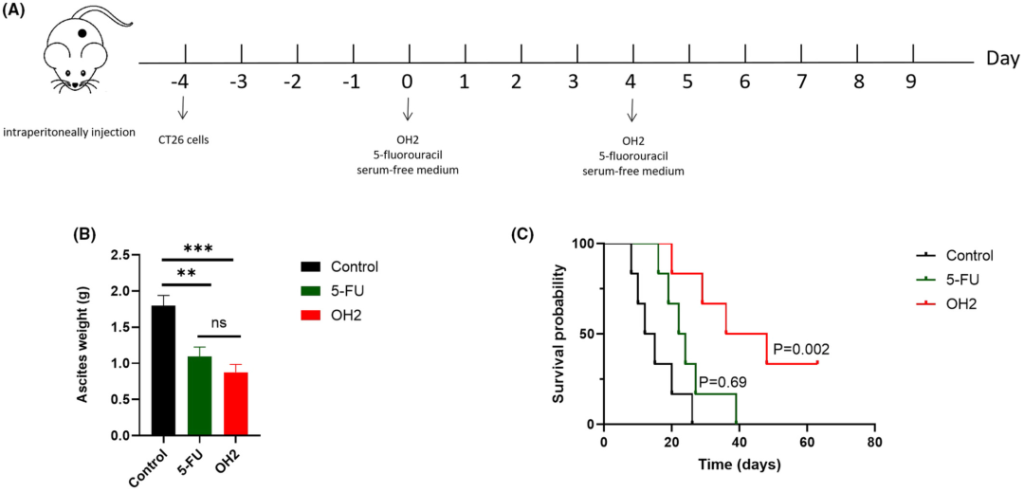
OH2抑制腹水生成,延长存活时间。(A)治疗方案的模式;(B)在第一次治疗后的第9天,OH2抑制了小鼠腹水重量中的腹水生成;(C)不同组中总存活时间的曲线。
3. 腹水中OH2感染后的细胞因子水平
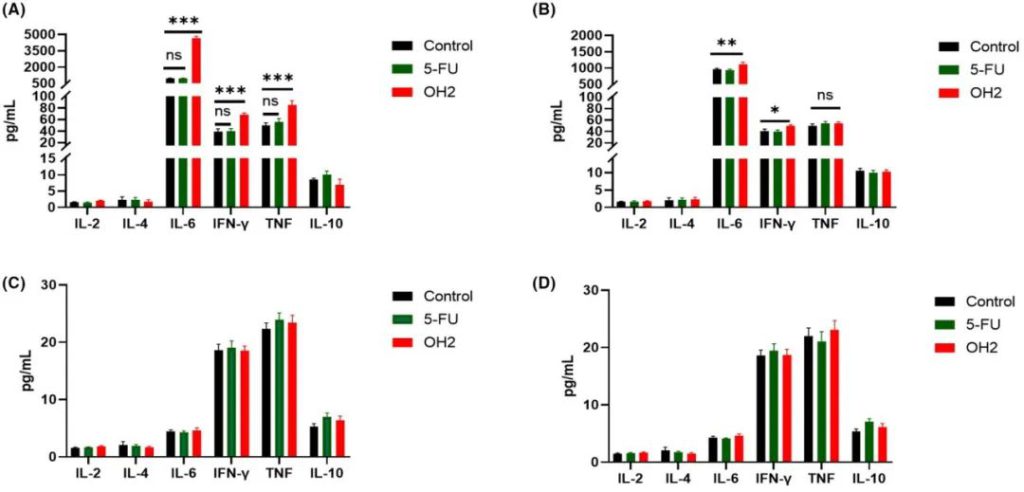
(A)自第一次治疗后第4天腹水的细胞因子水平;(B)自第一次治疗后第9天腹水的细胞因子水平;(C)自第一次治疗后第4天血清中的细胞因子水平;(D)第一次治疗后第9天血清中的细胞因子水平。
作者发现,OH2组小鼠在接受治疗后第4天,检测后发现其腹水中多种细胞因子水平(尤其是IL-6和IFN-γ)比对照组高(超过四倍),TNF和IFN-γ的水平也呈上升趋势(图3)。在实验结束时(第9天),仍有腹水的小鼠体内的细胞因子虽然略高于对照组,但是与之前相比显著下降。小鼠外周血细胞因子水平与腹水相比基本正常。结果表明,OH2可能是通过其直接的溶瘤细胞毒性作用促进炎症的发生从而导致细胞死亡,其特征是促炎细胞因子(主要是IL-6)的快速大量分泌。因此,是否存在区域细胞因子风暴以及如何激活免疫系统并协同发挥抗肿瘤作用是作者进一步研究的目的。
4. OH2激活腹水中的CD8+T和CD4+T细胞
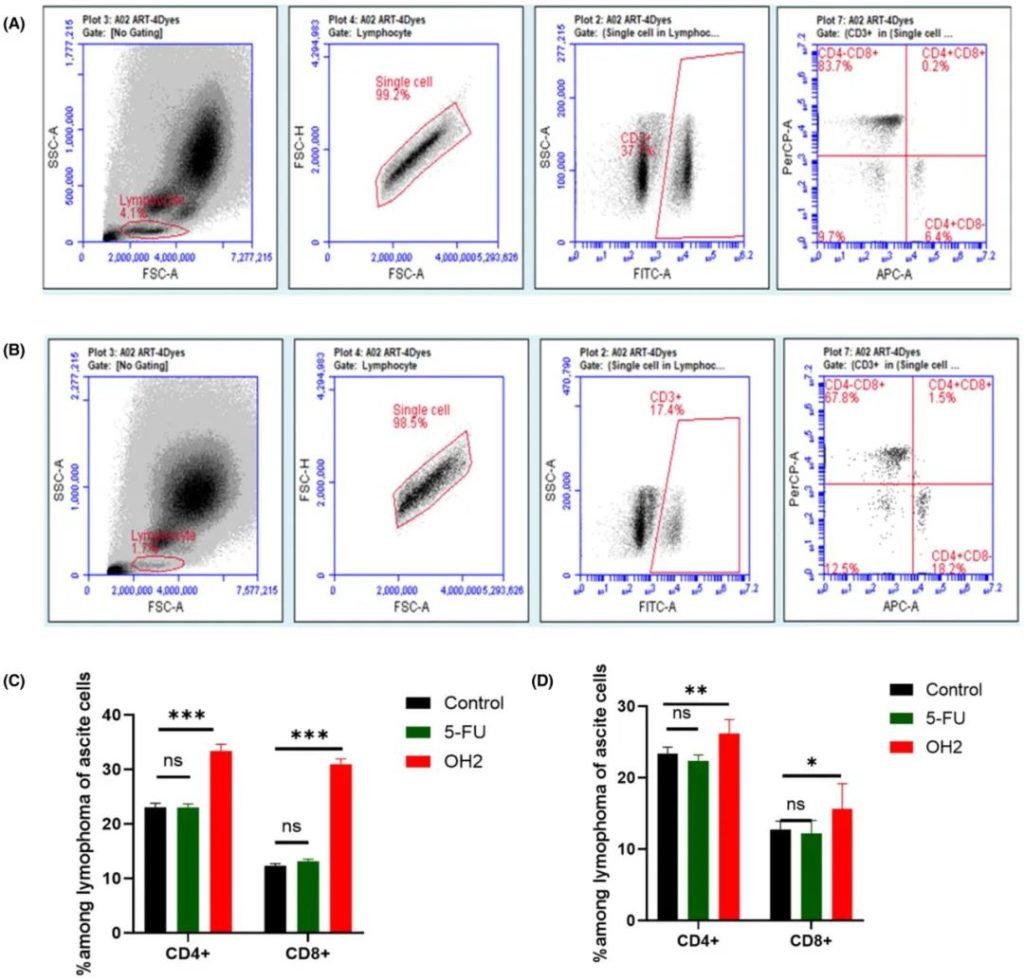
通过流式细胞仪分析,在第4天和第9天,OH2增加了小鼠腹水中CD4+和CD8+T细胞的数量。(A)对照组腹水中CD8+和CD4+T细胞;(B)OH2治疗腹水中的CD8+和CD4+T细胞;(C)第4天小鼠腹水中CD4+和CD8+T细胞的百分比;(D)第9天小鼠腹水中CD4+和CD8+T细胞的百分比,结果表明OH2可以促进各种淋巴细胞的增殖从而改变腹水的免疫微环境。
5. 通过scRNA-seq进行的T细胞亚群和功能分析
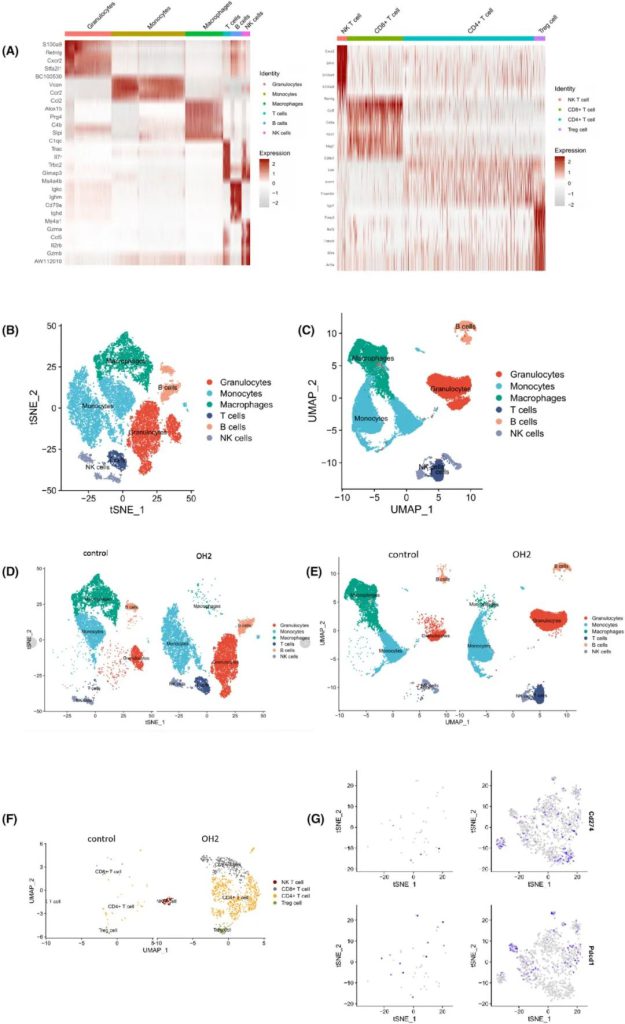
作者将T细胞分成不同的免疫群体组(图5),通过对每个群体的标记基因表达进行scRNA测序。作者发现在这六组细胞中(图5C),T细胞、单核细胞、巨噬细胞、B细胞、NK细胞和中性粒细胞的比例随着OH2感染而急剧变化。
对上调的T细胞中进一步分析显示,CD4+和CD8+T细胞数量都显著增加,其中CD4+的影响更强(图5E,F)。大量中性粒细胞的激活可能与细胞因子的释放有关,是导致局部细胞因子风暴的原因之一。
此外,注射OH2以后,NK细胞的比例随着IFN-γ的上调而轻度增加,IFN-γ是一种代表免疫刺激活性的细胞因子(图5C)。值得注意的是,免疫抑制性Treg细胞在OH2处理的腹水中也富集,这表明OH2对免疫微环境的调节不是直接的阴阳二元效应,而是交互影响。
同时,免疫抑制相关基因的表达水平随着T细胞比例的增加而升高。例如,作者在T细胞和嗜中性粒细胞的OH2治疗组中发现免疫检查点基因的上调,如Cd274(编码PD-L1)和Pdcd1(编码PD1)(图5F,H)。
6. 通过tocilizumab阻断IL-6信号通路下调OH2活性以消退腹水
通过tocilizumab(托珠单抗,IL-6受体抑制剂)阻断IL-6信号通路从而下调OH2活性。作者通过同步托珠单抗暴露在模型动物中显著消除了由OH2引起的延迟腹水生长的效果(图6),并且未能延长存活期,这与具有未受损IL-6信号传导的小鼠模型不同。
然而,当IL-6信号传导在病毒给药96小时后受到托珠单抗药理抑制作用时,腹水阻塞的OH2效应无法抵消,最终启动了有效的抗癌免疫。作者分析了六种细胞因子的水平,发现IL-6失活也可能导致TNF-α的强烈下调和IFN-γ的释放。值得注意的是,OH2在IL-6信号传导抑制后也不足以增加CD4+T细胞和CD8+T细胞的数量,这再次表明炎症风暴是免疫激活的主要原因。
7. 结果与讨论
OH2能够通过腹膜内注射消除腹水并显著延长携带CT26肿瘤细胞的小鼠的存活,即使局部细胞因子风暴也不会对主要器官造成明显的全身性损伤。与用5-氟尿嘧啶或无应答者治疗的小鼠相比,在用OH2治疗的腹水小鼠中观察到促炎细胞因子(主要是IL-6)的高分泌,以及CD4+和CD8+T细胞浸润的增加。此外,IL-6途径的初始阶段阻断能够显著抑制由OH2驱动的抗肿瘤免疫反应。
参考文献:
1.Dong, S, Liu, B, Hu, S, et al. A novel oncolytic virus induces a regional cytokine storm and safely eliminates malignant ascites of colon cancer. Cancer Med. 2022; 00: 1- 13. doi: 10.1002/cam4.4772
2.Wang Y., Jin J., Wu Z., Hu S., Hu H., Ning Z., Li Y., Dong Y., Zou J., Mao Z., Shi X., Zheng H., Dong S., et al Stability and anti-tumor effect of oncolytic herpes simplex virus type 2. Oncotarget. 2018; 9: 24672-24683. Retrieved from https://www.oncotarget.com/article/25122/text/
3.Jennifer C.C. Hu, Robert S. Coffin, Ceri J. Davis, Nicola J. Graham, Natasha Groves, Peter J. Guest, Kevin J. Harrington, Nicholas D. James, Colin A. Love, Iain McNeish, Louise C. Medley, Agnieszka Michael, Christopher M. Nutting, Hardev S. Pandha, Claire A. Shorrock, Julie Simpson, Jan Steiner, Neil M. Steven, Dennis Wright, R. Charles Coombes; A Phase I Study of OncoVEXGM-CSF, a Second-Generation Oncolytic Herpes Simplex Virus Expressing Granulocyte Macrophage Colony-Stimulating Factor. Clin Cancer Res 15 November 2006; 12 (22): 6737–6747. https://doi.org/10.1158/1078-0432.CCR-06-0759
