胶质母细胞瘤(GBM)是星形细胞肿瘤中恶性程度最高的胶质瘤,也是最常见的、极具侵袭性的原发性恶性脑肿瘤。这类肿瘤具有恶性程度极高,早期浸润的性质,无法完全通过手术切除,对化疗和放疗的内在耐药性也导致了较差的临床结果,绝大部分的患者预后极差:经标准的手术放化疗等治疗手段后,其生存中位数只在15个月左右,五年生存率低于5%,作为当今肿瘤治疗中的重大挑战之一,急需开发新的方法以改善患者的预后,提高其生存质量。
近年来,随着对免疫调节机制的深入研究,免疫检查点抑制剂的应用使肿瘤治疗从传统的放疗、化疗向精准靶向治疗发展,在黑色素瘤、肺癌等肿瘤的治疗中展现出显著成效。CD47与SIRPα协同作用,是肿瘤细胞逃脱巨噬细胞吞噬的重要免疫检查点。抗CD47抗体通常在人IgG4支架上进行工程设计,以最大限度地减少先天免疫的Fc依赖性效应功能。IgG1形式的抗CD47抗体具有更强的抗GBM活性。然而,直接使用IgG1形式的抗CD47抗体对GBM进行全身治疗,仍存在输注毒性和难以穿透血脑屏障等问题,
溶瘤病毒疗法是新兴的一种免疫疗法,使用具有复制能力的病毒选择性地复制和杀死癌细胞。溶瘤病毒(OVs)通过不同的机制导致癌细胞死亡,包括凋亡、焦脱和坏死。直接溶瘤释放广泛的肿瘤相关抗原(TAAs)/新抗原或危险相关分子模式和病毒病原体相关分子模式,在肿瘤微环境中触发炎症免疫反应 (TME)。 溶瘤单纯疱疹病毒-1(oHSV)是研究最广泛的溶瘤病毒之一,它可以选择性溶解癌细胞,同时使正常细胞基本保持完整。与许多其他溶瘤病毒一样,oHSV也能激活患者的免疫系统攻击肿瘤细胞。因此,以工程化 oHSV 表达可以增强免疫反应和/或阻断免疫检查点参与的转基因可能是提高 oHSV 对 GBM 的整体功效的有效方法。
2021年10月,美国希望之城国家医疗中心 Yu Jianhua 团队等在 Nature Communications 期刊上发表:“An oncolytic virus expressing a full-length antibody enhances antitumor innate immune response to glioblastoma”的研究论文。

该团队将溶瘤病毒疗法和抗体疗法相结合,以溶瘤单纯疱疹病毒作为治疗和抗体递送的平台,通过构建工程化溶瘤病毒,直接破坏肿瘤细胞,并将“冷肿瘤”转化为“热肿瘤”,调控肿瘤微环境间接破坏肿瘤细胞。
工程化的溶瘤单纯疱疹病毒诱导巨噬细胞的Fc受体介导的肿瘤吞噬和NK细胞的肿瘤细胞毒性,显著延长胶质母细胞瘤小鼠模型的存活时间。因此,工程化溶瘤单纯疱疹病毒是强化胶质母细胞瘤溶瘤病毒治疗的一种有希望且毒副作用极小的方法。
研究团队首先评估了六种人类GBM细胞系细胞表面表达CD47的水平,发现六种细胞系均在表面均匀表达CD47。然后,团队构建两种工程化溶瘤单纯疱疹病毒:以IgG1为支架的OV-αCD47-G1和以IgG4为支架的OV-αCD47-G4。
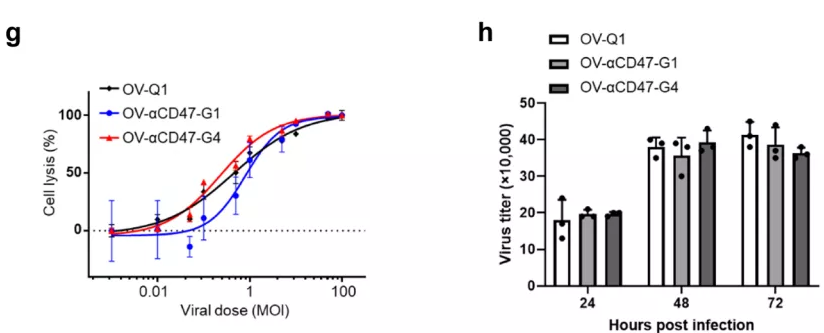
然后团队用两种病毒感染GBM细胞,结果发现在感染后的一段时间GBM细胞可持续释放出相当数量的CD47抗体(图1 g),同时,这两种工程化oHSV还发挥出强大且相似的溶瘤能力和复制病毒的能力(图1 h)。
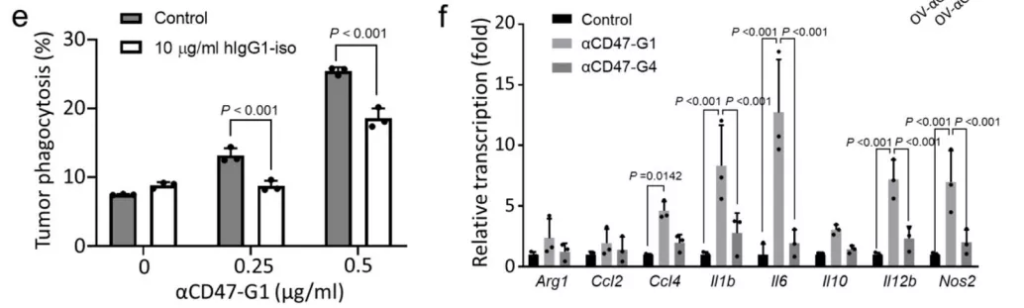
接下来,研究团队比较两种溶瘤病毒通过调节小鼠和人免疫细胞,杀死人类GBM细胞的能力。被溶瘤病毒感染的GBM细胞释放的αCD47-G1显著诱导了骨髓源性巨噬细胞(BMDM)去吞噬患者来源的GBM43细胞,而单纯对Fc受体进行阻断显著抑制了其诱导BMDM的吞噬作用(图2 e),这表明感染后的GBM细胞分泌αCD47-G1,阻断肿瘤细胞发出“不要吃我”信号,增强了巨噬细胞的吞噬作用 。此外,与αCD47-G4相较,αCD47-G1 更能诱导NK 细胞对 GBM 细胞的抗体依赖性细胞毒作用(ADCC)(图2 f)。
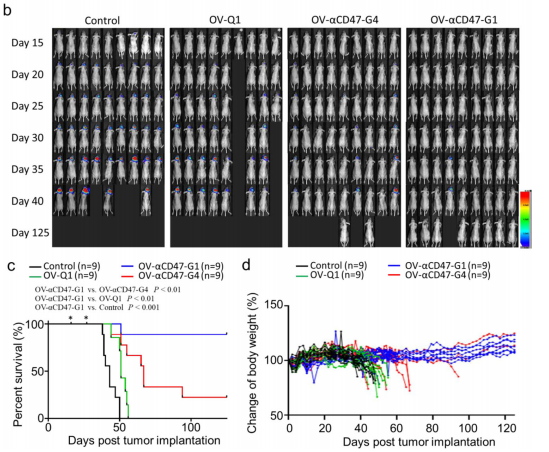
之后,研究团队通过构建无胸腺裸鼠构建GBM 小鼠模型,对OV-αCD47-G1与OV-αCD47-G4在人GBM原位模型中提高GBM体内溶瘤病毒治疗效果进行比较,结果表明OV-αCD47G1 在体内抑制 GBM 肿瘤进展方面明显比 OV-αCD47G4 更有效,并且两者都优于对照病毒 OV-Q1(图3)。
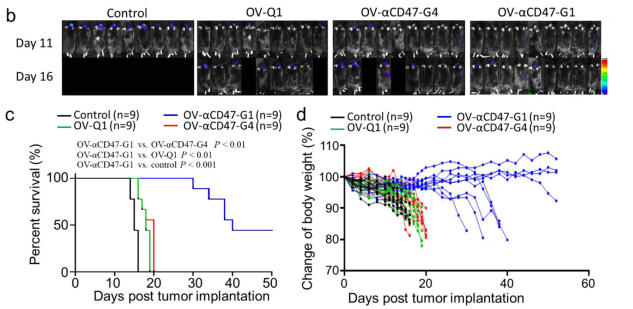
最后,研究团队评估了OV-αCD47-G1在免疫活性GBM小鼠模型中的疗效。他们使用了易受oHSV感染的改良CT2A小鼠GBM模型:将小鼠CT2A-GBM细胞修饰为表达人CD47的CT2A细胞。其目的是为了αCD47-G1抗体能与CT2A-hCD47 GBM细胞上表达的人CD47结合。通过将CT2A-hCD47细胞注射到具有免疫活性的野生型C57BL/6小鼠体内,他们建立了GBM免疫活性小鼠模型。与OV-αCD47-G4相比,OV-αCD47-G1组小鼠的中位生存期显著延长,表明表达以溶瘤病毒为平台表达全长IgG1CD47抗体是一种创新、方便,并能治疗实验性GBM的有效方法(图4)。
综上所述,该研究团队开发了一种有效的溶瘤单纯疱疹病毒工程化平台,通过感染直接诱导肿瘤溶解,并通过天然免疫浸润和激活、巨噬细胞的免疫检查点抑制和Fc依赖性天然免疫细胞细胞毒性功能,向局部区域输送全长单克隆抗体,用于治疗GBM。同时该平台可以尝试到表达其他靶向抗体,作用于肿瘤微环境中的免疫或肿瘤细胞,将溶瘤病毒疗法和单克隆抗体疗法结合,提高治疗肿瘤的疗效。
文章来源:https://doi.org/10.1038/s41467-021-26003-6
