过去十年免疫疗法的发展,改变了肿瘤治疗的模式。但是,多数患者仍然没有受益于免疫疗法,这可能与免疫抑制的肿瘤微环境(TME)相关。肿瘤细胞的代谢调节不仅在维持肿瘤生长方面起着重要的作用,而且其代谢产物也会影响免疫细胞的作用,导致免疫细胞营养供给不足,代谢失调,进而导致酸性的肿瘤微环境,影响免疫细胞的作用。通过靶向代谢药物,可以进一步重编程TME,增强抗肿瘤免疫反应。
该篇综述”Navigating metabolic pathways to enhance antitumour immunity and immunotherapy”主要介绍了影响抗肿瘤免疫反应的代谢途径及靶向代谢途径的药物,以增强免疫反应。
代谢是生物体内所发生的用于维持生命活动的一系列有序的化学反应的总称,这些反应不仅可以产生个体生存和维持细胞功能所需的能量,而且可以保持生物体的结构,及时对外界环境做出反应。代谢途径与细胞信号,表观遗传等密切相关,因此代谢途径在细胞稳定,响应细胞内外刺激时发挥重要作用。
1. 糖代谢
异常的生物能量活动使得肿瘤细胞摄取大量的葡萄糖,通过糖酵解途径产生乳酸,即使在有氧条件下,也会产生大量乳酸,同时氧化磷酸化的速率降低。这种现象被称为Warburg效应。乳酸在细胞中的积累,激活细胞膜上的单羧酸盐转运蛋白(MCT),特别是单羧酸盐转运蛋白(MCT4),而这种转运蛋白可以将乳酸运送到细胞外环境,导致酸性肿瘤微环境,抑制肿瘤免疫以促进肿瘤的发展。
此外,乳酸的大量积累,也会导致TILs的mTOR活性降低,NFAF信号和及糖酵解能力降低,最终导致抗肿瘤效应分子活性受损,抗肿瘤免疫反应降低。特别是严重影响了T细胞介导的抗肿瘤免疫应答及TILs的活率(图1)。酸性的肿瘤微环境利于肿瘤免疫细胞的发育,包括耐受性的DCs,M2样巨噬细胞和MDSC等;而不利于DC和M1型巨噬细胞的成熟和分化。此外,乳酸还会影响NK细胞的功能,影响IFNγ的分泌。实际上,肿瘤细胞产生的乳酸还可以通过促进IL-23和IL-17介导的的炎症反应而促进肿瘤的生长。除调节免疫应答外,肿瘤细胞可以将肿瘤相关成纤维细胞(CAF)产生的乳酸作为自身生长的能量来源。
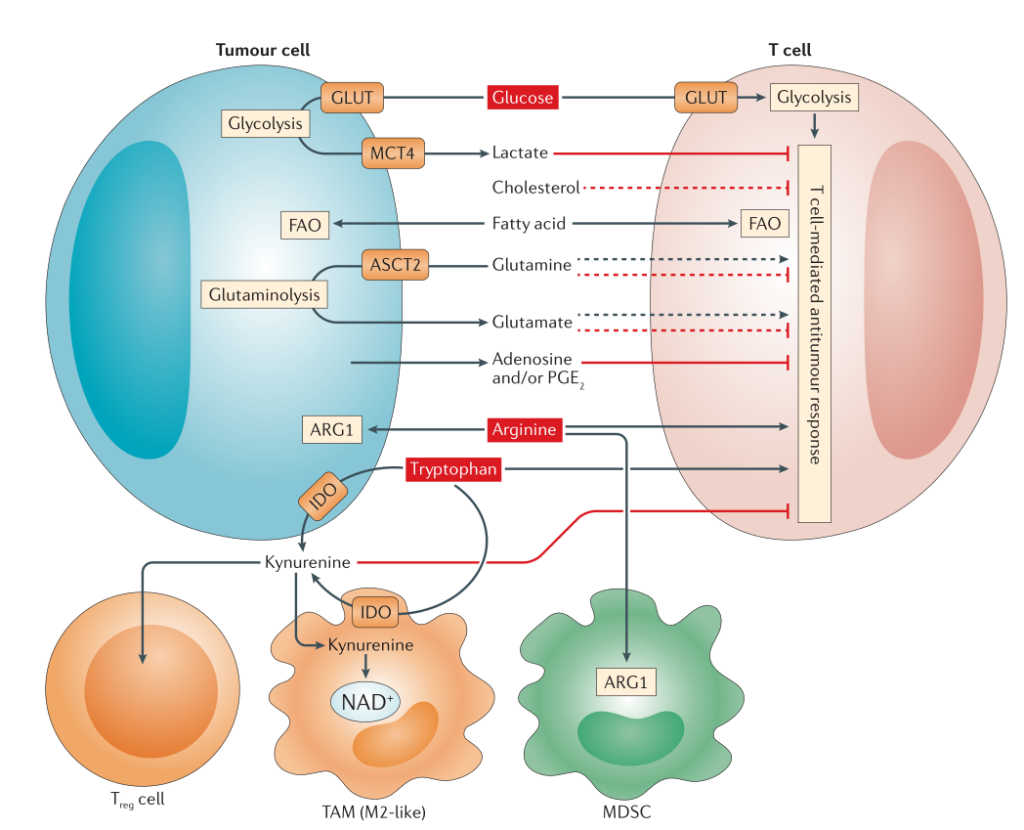
若干临床研究结果表明,肿瘤中有氧糖酵解活性与宿主抗肿瘤免疫反应和抗肿瘤免疫疗法的治疗结果呈负相关。例如,对于过继性T细胞疗法(ACT)不敏感的肿瘤,具有更高的糖酵解活性;对黑色素瘤患者进行相干检测发现,乳酸脱氢酶A(LDHA)和乳酸的表达水平与T细胞活性和患者的整体生存率呈现负相关。这些结果表明糖酵解活动不仅为肿瘤细胞的生长提供了能量,而且还可以帮助肿瘤细胞免疫逃逸。
基于此,靶向葡萄糖代谢和乳酸产生和分泌是抗肿瘤治疗的有效策略。例如,PFKFB3(可以促进肿瘤中的糖酵解活性和乳酸的产生)抑制剂已被证明,可以消除Warburg效应,减少肿瘤进展和转移。FX11(LDHA抑制剂)可以降低肿瘤生长。此外,也有靶向糖酵解药物与免疫检查点抑制剂联合治疗肿瘤。例如,PKM2(在糖酵解过程中可以将磷酸丙酮酸转化为丙酮酸的酶)可以联合PD-1或PDL1抑制剂来增强抗肿瘤免疫反应。这些结果共同表明,通过减少乳酸的产生可以增强抗肿瘤免疫疗法的疗效。但是,靶向糖酵解是一把双刃剑,一方面会对包括T细胞,NK细胞等在内的免疫细胞产生影响,抑制其功能,另一方面也会抑制由IL-7,IL-6和IL-23介导的促肿瘤反应。因此需要综合考虑,确保持续有效的抗肿瘤反应。同时需要探索肿瘤发生不同阶段糖酵解途径,以便使用合适的靶向药物。
2.基酸代谢
2.1谷氨酰胺和谷氨酸
谷氨酰胺在维持细胞生长过程中起着重要作用,在缺乏能量情况下,肿瘤细胞也可以通过谷氨酰胺途径获取细胞生存能量。其代谢产物如谷氨酸,α-KG和天冬氨酸可以调节细胞代谢,表观遗产学,核苷酸合成和氧化还原反应等。此外,糖酵解活动也会影响谷氨酰胺的代谢。糖酵解的代谢产物乳酸可以通过诱导HIF2α的表达,促进谷氨酰胺转运蛋白(ASCT2)和谷氨酰胺酶1(GLS)的表达,以此诱导肿瘤中谷氨酰胺分解的增加(图1)。此外,谷氨酰胺对于维持免疫应答也发挥着重要的作用。活化的T细胞和巨噬细胞通过上调谷氨酰胺的表达,增加免疫应答的能力。谷氨酰胺的缺乏可以抑制T细胞的活化和细胞因子的产生。因此,靶向谷氨酰胺成为治疗肿瘤的另一个有效策略。但是,靶向谷氨酰胺代谢的干预措施同时影响TME和抗肿瘤免疫的状态,需进一步确定谷氨酰胺如何调控TME细胞中谷氨酰胺代谢以及谷氨酰胺调控T细胞的潜在机制,有利于靶向药物的研发。目前CB-839是比较理想的药物,正在实体瘤和血液肿瘤中进行相关临床试验。
2.2 精氨酸
精氨酸的代谢在T细胞活化和调节免疫应答中起着关键的作用。在TME中聚集了表达精氨酸酶1(ARG1)免疫调节细胞,包括M2样的巨噬细胞(TAMS),DC和Treg细胞,可以通过降解精氨酸并限制T细胞的摄取,从而抑制抗肿瘤免疫反应。此外,有研究发现,额外补充精氨酸可以刺激T细胞和NK细胞的细胞毒活性和效应细胞因子的产生,联合PD-1抗体,可以进一步增强小鼠的抗肿瘤免疫能力,延长小鼠生存期。因此增加精氨酸分泌和防止精氨酸在TME中降解是重新激活T细胞和NK细胞介导免疫应答的非常具有吸引力的策略之一。目前AGR1抑制剂INCB001158联合pembrolizumab正在进行临床试验。
2.3 色氨酸
色氨酸是生物体进行蛋白质合成和生物代谢所必需的氨基酸之一。生物体内一般通过两种色氨酸降解酶(吲哚胺2,3-二氧化酶(IDO)和色氨酸2,3-二氧化酶(TDO)),可以将色氨酸分解为犬尿氨酸,并为NAD+合成提供原料。而肿瘤细胞高表达色氨酸降解酶,导致肿瘤的发展并抑制T细胞的抗肿瘤能力(图1)。此外,有研究发现,减少IDO的表达可以减少M2型巨噬细胞;IDO沉默的DC细胞可以增加抗原特异性的T细胞的增殖和细胞毒活性,促进肿瘤特异性T细胞的活化。基于此,IDO的抑制剂是增强抗肿瘤应答的一种比较有前途的方法。
目前IDO抑制剂联合CTLA-4抗体(ipilimumab)正在进行临床试验,用于评估在黑色素瘤患者中的疗效。总之,评估肿瘤中IDO的表达水平,及治疗前的IDO表达与T细胞浸润的关系,可能是优化这种方法的关键。在这里需要注意的一点是,在TME中IDO抑制剂会损害NAD+的产生,而NAD+是维持T细胞免疫反应关键的物质。因此在使用IDO抑制剂时需要综合考虑。
2.4 其他
此外,2-羟基戊酸盐,亚甲基丁二酸和PGE2途径都与TME中免疫细胞的抗肿瘤反应密切相关。例如,大部分胶质瘤细胞高表达异柠檬酸脱氢酶1(IDH1)或IDH2的突变体,促进肿瘤的发生,抑制T细胞的浸润。目前IDH1抑制剂联合Nivolumab正在进行临床试验。
3. 脂肪酸代谢
肿瘤细胞通常具有较高的脂肪酸合成速率,这样可以为磷脂和信号分子的生成提供能量。此外,脂肪酸合成可以为免疫细胞增殖提供细胞膜和其他关键的脂质细胞结构,也是炎症巨噬细胞分化和功能所必需的。例如,有效的TCR聚集和形成免疫突触对于T细胞功能是至关重要,而这依赖于细胞膜的脂质组分。不同的脂肪酸对CD4+T细胞增殖和分化发挥不同的功能。如,长链脂肪酸促进CD4+T向TH1和Th17细胞分化,而短链脂肪酸促使CD4+T向Treg细胞分化。因此TME中脂肪酸的类型决定了其浸润的CD4+T细胞的类型及其抗肿瘤作用。
脂肪的累积会使肿瘤浸润的免疫细胞(包括MDSC,DC和TAMS)通过代谢的重编程向免疫抑制和抗炎型表型分化。这些发现共同表明,TME中脂质代谢在协调免疫抑制和通过靶向代谢途径提高抗肿瘤免疫能力中发挥着重要功能,为提高机体抗肿瘤免疫能力提供了一个新的策略。
4. 训练型免疫力
训练型的免疫力是一种特别的免疫反应,它可以通过训练刺激物,如β-葡聚糖,长期提高先天免疫细胞的活性,并通过代谢诱导表观遗传的重编程。考虑到先天免疫细胞在免疫抑制TME形成过程中的重要作用,在TAMs和肿瘤浸润DCs中,刺激训练免疫通过重编程TME代谢,使其更具免疫刺激作用,从而能够与其他免疫疗法产生协同作用,如α-KG、乙酰辅酶A等。这种训练刺激已在不同试验中得到应用,其目的是引起抗肿瘤反应。
5. 免疫检查点
ICIs是肿瘤治疗比较有效的方法,通过增强T细胞活化信号通路从而增强抗肿瘤能力,但是新的证据表明,ICIs也会影响T细胞的代谢(图2)。例如,PD1与配体PDL1或PDL2结合,通过抑制PI3K-AKT-mTOR信号而影响代谢的重编程,包括有氧糖酵解和谷氨酰胺分解的上调。因此抑制PD1/PDL1信号通路,可以促使TILs的重新活化和代谢适应,同时抑制肿瘤细胞中的有氧糖酵解,从而起到协调的抗肿瘤作用。与抑制性免疫检查点受体引起的代谢损伤相反,协同刺激分子通过转录重编程和代谢开关的信号通路来维持T细胞的活化。例如,CD28信号通过同时刺激有氧糖酵解和促进线粒体融合,从而有效地产生乙酰辅酶A来增强T细胞的代谢 (图2)。类似地,4-1BB信号传导,极大的增强了CD8+T细胞增殖,同时激活葡萄糖和脂肪酸代谢。目前,越来越多的证据表明共刺激受体对T细胞代谢会产生的重大影响。因此ICIs和协调刺激分子的联合疗法是另一种比较有前途的治疗方法。
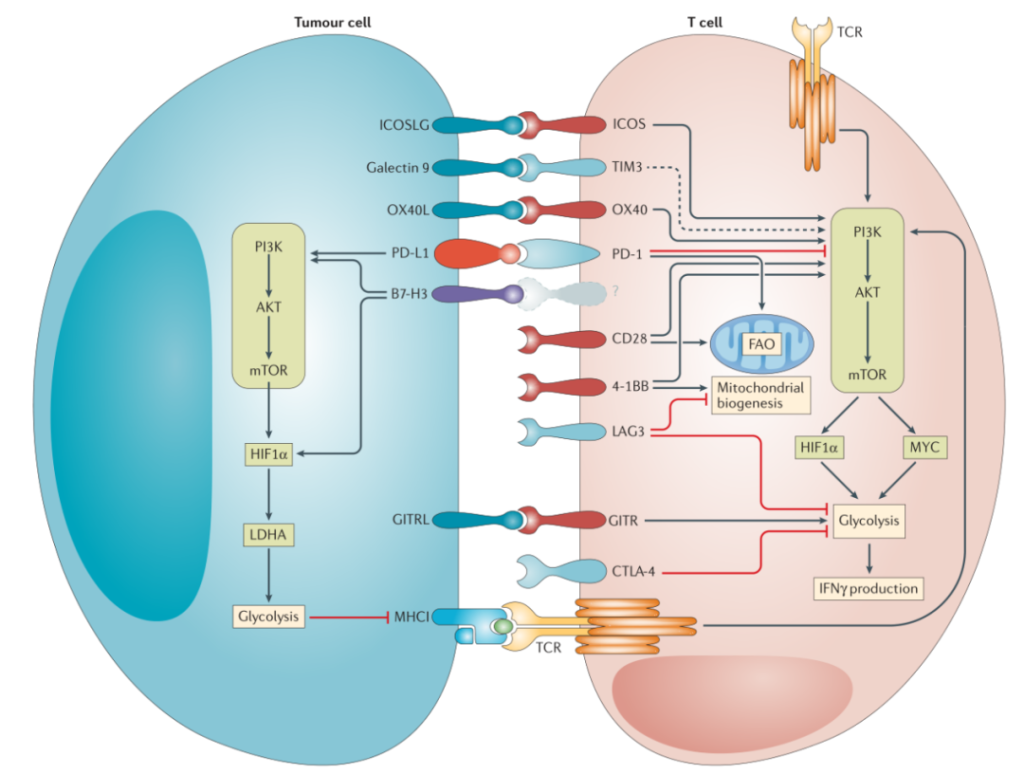
6. T细胞的线粒体调节
TCR刺激能够诱导线粒体的重塑,这是满足T细胞活化的代谢需求所必需的。TCR活化还能刺激线粒体反应性样物质(ROS)的生成,同时又可以驱动T细胞活化。
过氧化物酶体增殖物激活受体γ共激活因子1 (PGC-1α )是核激素受体过氧化物酶体增殖物激活受体γ( PPARγ)的转录共激活因子,广泛参与线粒体生物合成等多条代谢途径。研究发现,通过4-BB刺激使细胞过表达PGC1α,可以维持线粒体的功能和避免TILs的耗竭,从而达到抗肿瘤效果;此外,PPAR-PGC1α激动剂与PD-1抗体联合使用后,可以增加线粒体的生物学活性。同时增加T细胞的抗肿瘤活性。
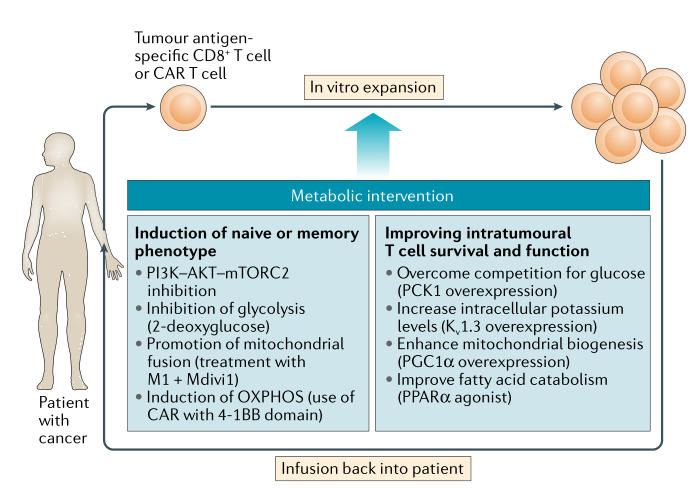
7. ACT中的代谢干预措施
ACT疗法在肿瘤治疗中发挥着重要的作用,但是分离的TILs属于终末分化细胞,因此生存周期较短。但是当TILs细胞内具有较高浓度的钾离子时,能够抑制TCR驱动的AKT-mTOR信号,达到提高抗肿瘤能力的作用。此外,CAR-T疗法也是目前比较有前景的免疫疗法。研究发现,AKT和PI3K抑制剂可以改变CAR-T的代谢,增强其抗肿瘤效果。这些研究共同表明AKT-mTOR信号在促进T细胞终末分化和活化中发挥重要功能(图3)。
8. 总结
了解肿瘤细胞和免疫细胞的代谢重编程如何调节抗肿瘤免疫反应,可以使我们在抗肿瘤免疫治疗中寻找到合适的靶向代谢途径的治疗手段。因此,理解和利用TME中各种代谢的关系可以提高免疫疗法的低应答率。值得注意的是,代谢编程也影响抗原的表达和识别。因此,代谢干预不仅能够改善免疫细胞对高免疫原性肿瘤的反应,而且能够增加肿瘤细胞的免疫原性,从而扩大免疫疗法治疗的范围。
